题目内容
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是
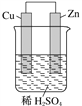
①铜为阳极,锌为阴极;②铜极上有气泡;③SO![]() 向铜极移动;
向铜极移动;
④若有0.5 mol 电子流经导线,则可产生0.25 mol气体;
⑤电子的流向是铜到锌;⑥正极反应式:Cu+2e-===Cu2+。
A. ①②③ B. ②④
C. ④⑤⑥ D. ③④⑤
【答案】B
【解析】①锌的金属性强于铜,Cu为正极,Zn为负极,①错误;②铜电极上氢离子放电,产生氢气,②正确;③原电池中阴离子硫酸根向负极(Zn极)移动,③错误;④产生1mol氢气,转移2mol电子,所以若有0.5 mol电子流经导线,则可产生0.25 mol气体,④正确;⑤锌是负极,电子的流向是Zn→Cu,⑤错误;⑥、正极反应式:2H++2e-===H2↑,⑥错误,故①③⑤⑥错,②④正确,答案选B。

练习册系列答案
相关题目
