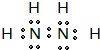题目内容
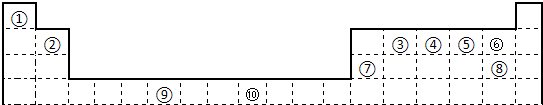
(14分)下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物能使澄清石灰水变浑浊。有关该化合物分子的说法正确的是 。
A.分子中含极性共价键 B.属于非极性分子
C.含有1个σ键和2个π键 D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
I、金属性最强的主族元素是_____________(填元素名称);
II、⑤、⑥、⑦的离子半径由小到大的顺序是_______________________(填化学式)
III、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是_________
(填化学式),
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 _____________;该元素与元素①形成的分子X的空间构型为 。
【答案】
(14分)
(1) ⑩(2分) (2)A B (2分)
(3)I、钙 (2分)II、Al3+< Cl-< S2- (2分) III、 HClO4 > H2SO4 (2分)
(4) 3 (2分) 三角锥型 (2分)
【解析】

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目