题目内容
8.有A、B、C、D四种金属.将A与B用导线连接起来浸入稀硫酸中,B上有气泡产生;将A、D分别投入到等浓度的稀盐酸中,D比A反应剧烈;将Cu浸入B的盐溶液中,无明显变化;如果把Cu浸入C的盐溶液中,有金属C析出.据此判断它们的活动性由强到弱顺序是( )| A. | C>B>A>D | B. | D>A>B>C | C. | D>B>A>C | D. | B>A>D>C |
分析 一般来说,原电池中,较活泼的金属作负极、较不活泼的金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应;金属的金属性越强,金属单质与水或酸反应越剧烈,较活泼金属能置换出较不活泼金属,据此分析解答.
解答 解:一般来说,原电池中,较活泼的金属作负极、较不活泼的金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应;金属的金属性越强,金属单质与水或酸反应越剧烈,较活泼金属能置换出较不活泼金属,
将A与B用导线连接起来浸入稀硫酸中,该装置构成原电池,B上有气泡产生,说明B电极上得电子发生还原反应,则B是正极、A是负极,金属活动性A>B;
将A、D分别投入到等浓度的稀盐酸中,D比A反应剧烈,则金属活动性D>A;
将Cu浸入B的盐溶液中,无明显变化,说明金属活动性B>Cu;
如果把Cu浸入C的盐溶液中,有金属C析出,说明金属活动性Cu>C;
通过以上分析知,金属活动性顺序是D>A>B>C,故选B.
点评 本题考查金属活动性强弱判断,侧重考查学生分析判断能力,明确金属活动性强弱判断方法是解本题关键,可以根据金属之间的置换反应、金属与水或酸反应剧烈程度、金属最高价氧化物的水化物碱性强弱、原电池原理等方法判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.某烃结构简式如图: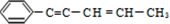 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )
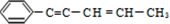 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 所有原子不可能在同一条直线上 | ||
| C. | 所有碳原子可能在同一平面上 | D. | 该烃属于苯的同系物 |
19.一定条件下,卤代烃和金属钠能发生伍兹反应:R-X+2Na+R′-X→R-R′+2NaX,反应中有C-X键的断裂和C-C键的形成.据此,以下卤代烃伍兹反应的可能产物(不考虑NaX)及命名不合理的是( )
| A. | 一氯甲烷和2-氯丙烷:正丁烷 | |
| B. | 2,2-二甲基-1-氯丙烷与一氯甲烷:2,2-二甲基丁烷 | |
| C. | 1,5-二氯戊烷:环戊烷 | |
| D. | 一氯甲烷和四氯化碳:2,2-二甲基丙烷 |
16.如图是某有机物分子的简易球棍模型.下列关于该有机物的说法中错误的是( )


| A. | 分子式为C3H7O2N | |
| B. | 该有机物能发生缩聚反应 | |
| C. | 能通过聚合反应生成高分子化合物 | |
| D. | 具有相同官能团的该有机物的同分异构体还有两种 |
3.1989年,IUPAC(国际纯粹与应用化学联合会)建议用1~18列替代原主族、副族等.下列有关说法错误的是( )
| A. | 元素周期表中第3列的元素种类数最多 | |
| B. | 金属性最强的元素位于元素周期表的第1列 | |
| C. | 非金属性最强的元素位于元素周期表的第17列 | |
| D. | 能形成化合物的种类数最多的元素位于元素周期表的第16列 |
13.已知化合物NH5的结构和NH4Cl相似,下列关于NH5的下列说法中正确的是( )
| A. | NH5是共价化合物 | |
| B. | NH5的电子式为NH4+[:H]- | |
| C. | NH5中氢元素呈价+1和-1价 | |
| D. | NH5与水发生氧化还原反应,置换出氢气 |
17.下列属于链烃的是( )
| A. | CH3CH2Cl | B. | 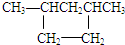 | C. | 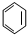 | D. | CH4 |
18.如表为元素周期表中的一部分,列出11种元素在元素周期表中的位置.用化学符号回答下列各问题.
(1)11种元素中,第一电离能最小的是K;电负性最大的是F.(都用化学符号表示)
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,呈两性的是Al(OH)3.(填化学式)
(3)元素②的氢化物的电子式为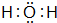 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
(4)④和⑦的最高价氧化物对应水化物的化学式分别为NaOH和HClO4.④和(11)两元素形成化合物的化学式为NaBr; 该化合物灼烧时的焰色为黄色
(5)第一电离能:⑤>⑥(填“>”“<”“=”),请说明原因:Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低.
| 主族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | VII | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | (11) |
(2)④、⑤、⑥三种元素最高价氧化物对应的水化物中,呈两性的是Al(OH)3.(填化学式)
(3)元素②的氢化物的电子式为
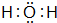 ;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑
;该氢化物常温下和元素④的单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑(4)④和⑦的最高价氧化物对应水化物的化学式分别为NaOH和HClO4.④和(11)两元素形成化合物的化学式为NaBr; 该化合物灼烧时的焰色为黄色
(5)第一电离能:⑤>⑥(填“>”“<”“=”),请说明原因:Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低.

 +H2O;n HOCH2CH2OH+n HOOC-COOH
+H2O;n HOCH2CH2OH+n HOOC-COOH 
 +(2n-1)H2O.
+(2n-1)H2O.