题目内容
【题目】硫单质及其化合物在化工生成等领域应用广泛,工业尾气中的SO2一直是环境污染的主要原因之一。
I.SO2尾气的处理
方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a.CaO(s)+CO(g) = CaCO3(s) ΔH= 178.3kJ·mol1
b.2CaCO3(s)+2SO2(g)+O2(g)= 2CaSO4(s)+2CO2(g) ΔH= 2762.2kJ·mol1
c.2CaSO3(s)+O2(g)= 2CaSO4(s) ΔH= 2314.8kJ·mol1
(1)写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:___。
方法2:用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4。
(2)实验测得NH4HSO3溶液中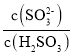 =1500,则溶液的pH为________(已知:H2SO3的Ka1=1.5×102,Ka2=1.0×107,K(NH3·H2O)=1.74×10-5;)。NH4HSO3溶液中所含粒子浓度大小关系正确的是_____。
=1500,则溶液的pH为________(已知:H2SO3的Ka1=1.5×102,Ka2=1.0×107,K(NH3·H2O)=1.74×10-5;)。NH4HSO3溶液中所含粒子浓度大小关系正确的是_____。
A c(NH4+)>c(HSO3-)>c(H+)>c(SO32)>c(OH-)
B c(HSO3-)>c(NH4+)>(SO32-)>c(H+)>c(OH-)
C c(NH4+)+c(NH3·H2O)=c(HSO3-)+2c(SO32)+c(H2SO3)
D c(H+)+c(H2SO3)=c(OH-)+c(SO32)+c(NH3·H2O)
II.SO2的回收利用:
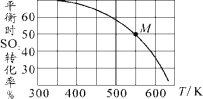
(3)SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g)+Cl2(g)![]() SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如下图所示:
SO2Cl2(g)。按投料比1:1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如下图所示:
①恒温恒压条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是_______(填字母)。
a SO2Cl2的浓度保持不变 b 混合气体的压强不再改变
c 混合气体的密度不再改变 d 混合气体的平均相对分子质量不再改变
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=_____(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
III.(4)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为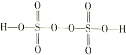 。在工业上用作强氧化剂。
。在工业上用作强氧化剂。
①在Ag+催化作用下,S2O82能与Mn2+在水溶液中发生反应生成SO42和MnO4,1molS2O82能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为________。
【答案】CaO(s)+SO2(g)=CaSO3(s)ΔH=402.0kJ·mol1 6 AD b 3/p 0.4 2SO422e= S2O82
【解析】
(1)CaO(s)与SO2(g)反应生成CaSO3(s)方程式为:CaO(s)+SO2(g)=CaSO3(s),可以由反应![]() 得到,根据盖斯定律,反应的焓变△H=
得到,根据盖斯定律,反应的焓变△H=![]() =-402.0kJmol-1,即热化学方程式:CaO(s)+SO2(g)=CaSO3(s)△H=-402.0kJmol-1;
=-402.0kJmol-1,即热化学方程式:CaO(s)+SO2(g)=CaSO3(s)△H=-402.0kJmol-1;
(2)H2SO3的Ka1=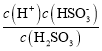 ,Ka2=
,Ka2=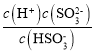 ,所以
,所以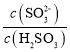 =
=![]() =1500,将Ka1=1.5×102,Ka2=1.0×107带入可解得c(H+)=10-6mol/L,则pH=-lgc(H+)=6;
=1500,将Ka1=1.5×102,Ka2=1.0×107带入可解得c(H+)=10-6mol/L,则pH=-lgc(H+)=6;
(3)NH4HSO3溶液中存在铵根的水解,其水解平衡常数Kh=![]() ,存在HSO3-的电离和水解,其电离平衡常数为Ka2=1.0×107,其水解平衡常数Kh2=
,存在HSO3-的电离和水解,其电离平衡常数为Ka2=1.0×107,其水解平衡常数Kh2=![]() ,NH4+的水解程度大于HSO3-的水解,HSO3-的电离大于水解,所以溶液显酸性,c(H+)>c(OH-);
,NH4+的水解程度大于HSO3-的水解,HSO3-的电离大于水解,所以溶液显酸性,c(H+)>c(OH-);
A.NH4+水解程度比HSO3-的电离程度小,且HSO3-会水解,所以c(NH4+)>c(HSO3-),HSO3-电离出氢离子,且大于水解,NH4+水解也生成氢离子,所以c(H+)>c(SO32),溶液呈酸性,水解是微弱的,所以c(NH4+)>c(HSO3-)>c(H+)>c(SO32)>c(OH-),故A正确;
B.根据分析A项正确,则B错误;
C.根据物料守恒可知:c(NH4+)+c(NH3·H2O)=c(HSO3-)+c(SO32)+c(H2SO3),故C错误;
D.溶液中存在电荷守恒:c(NH4+)+ c(OH-)= c(HSO3-)+2c(SO32)+c(H+),与物料守恒式联立消去c(NH4+)可得:c(H+)+c(H2SO3)=c(OH-)+c(SO32)+c(NH3·H2O),故D正确;
综上所述选AD;
(3)①a.当反应达到平衡时各组分的浓度不再改变,所以SO2Cl2的浓度保持不变说明反应达到平衡,故a不选;
b.恒温恒压条件下混合气体的压强一直不变,故b选;
c.恒压条件下,平衡移动过程中容器体积会发生变化,而气体的质量不变,所以平衡移动时密度发生改变,当密度不变时说明反应达到平衡,故c不选;
d.气体质量一直不变,平衡移动过程中气体的总物质的量会发生改变,所以平均相对分子质量会发生改变,当其不变时说明反应达到平衡,故d不选;
综上所述选b;
②据图可知M点SO2的转化率为50%,不妨设初始投料为

相同条件下气体压强之比等于物质的量之比,所以p(SO2)= p(Cl2)= p(SO2Cl2)=![]() p,所以Kp=
p,所以Kp= ;
;
(4)①根据过二硫酸的结构式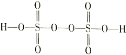 可知过二硫酸中S为+6价,两个O为-1价,S2O82与Mn2+反应时-1价的O被还原成-2价,Mn2+被氧化成+7价,升高5价,1molS2O82能得到2mol电子,所以可以氧化Mn2+的物质的量为0.4mol;
可知过二硫酸中S为+6价,两个O为-1价,S2O82与Mn2+反应时-1价的O被还原成-2价,Mn2+被氧化成+7价,升高5价,1molS2O82能得到2mol电子,所以可以氧化Mn2+的物质的量为0.4mol;
②电解池中阳极发生氧化反应,用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵时,硫酸根被氧化成S2O82,所以阳极反应为:2SO422e= S2O82。

【题目】下表是元素周期表的一部分,表中的字母分别代表一种化学元素。

(1)上述元素中,原子中未成对电子数最多的是 ___________ (填字母),写出该元素基态原子的核外电子排布式: ___________ 。
(2)根据下表所提供的电离能数据,回答下列问题。
锂 | X | Y | |
I1 | 520 | 496 | 580 |
I2 | 7296 | 4562 | 1820 |
I3 | 11799 | 6912 | 2750 |
I4 | 9543 | 11600 |
①表中X可能为以上13种元素中的 _____________ (填字母)元素。用元素符号表示X和j形成的一种化合物的化学式: _____________ 。
②Y是周期表中第 _____________ 族元素。
【题目】I.常温下,HNO2电离反应的平衡常数值为2.6×10-4。NaNO2是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(1)某活动小组同学设计实验方案鉴别 NaCl溶液和NaNO2溶液,请填写下列表格。
选用药品 | 实验现象 | 利用NaNO2的性质 |
①酚酞试液 | ____________ | ____________ |
②淀粉-KI试纸 | ____________ | ____________ |
(2)亚硝酸钠有毒,不能随意排放,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则该气体为____________(填化学式)。
II.活动小组同学采用如下装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略)。
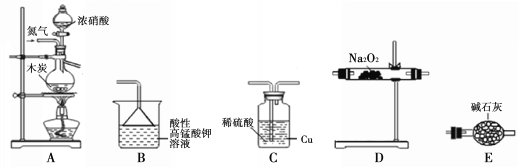
已知: ①2NO + Na2O2 =2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色。
(1)实验装置的连接顺序为____________;
(2)C瓶内发生反应的离子方程式为____________。
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①第一组实验数据出现较明显异常,造成异常的原因可能是__________(填字母序号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为____________。
(4)设计实验,比较0.1mol·L-1NaNO2溶液中NO2-的水解程度和0.1mol·L-1HNO2溶液中HNO2电离程度的相对大小_______(简要说明实验步骤、现象和结论,仪器和药品自选)。