题目内容
【题目】I.常温下,HNO2电离反应的平衡常数值为2.6×10-4。NaNO2是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(1)某活动小组同学设计实验方案鉴别 NaCl溶液和NaNO2溶液,请填写下列表格。
选用药品 | 实验现象 | 利用NaNO2的性质 |
①酚酞试液 | ____________ | ____________ |
②淀粉-KI试纸 | ____________ | ____________ |
(2)亚硝酸钠有毒,不能随意排放,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则该气体为____________(填化学式)。
II.活动小组同学采用如下装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略)。
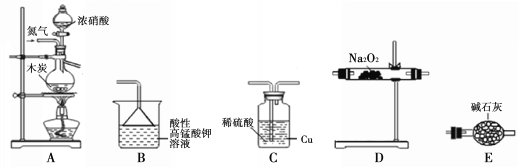
已知: ①2NO + Na2O2 =2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色。
(1)实验装置的连接顺序为____________;
(2)C瓶内发生反应的离子方程式为____________。
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①第一组实验数据出现较明显异常,造成异常的原因可能是__________(填字母序号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为____________。
(4)设计实验,比较0.1mol·L-1NaNO2溶液中NO2-的水解程度和0.1mol·L-1HNO2溶液中HNO2电离程度的相对大小_______(简要说明实验步骤、现象和结论,仪器和药品自选)。
【答案】 溶液变红 溶液显碱性 试纸变蓝 氧化性 N2 A C E D E B Cu + 2H+ + NO2= Cu2+ + NO + H2O ac 86.25% 25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度(合理方法均可给分)。
【解析】I.(1)亚硝酸是弱酸,亚硝酸钠水解溶液显碱性,能使酚酞试液显红色,而氯化钠不水解,溶液显中性,据此可以鉴别二者;另外亚硝酸钠还具有氧化性,能把碘化钾氧化为单质碘,碘遇淀粉显蓝色,而氯化钠和碘化钾不反应,据此也可以鉴别;(2)亚硝酸钠与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,根据性质和原子守恒可知该气体为氮气,化学式为N2;II.(1)碳和浓硝酸反应生成的气体是CO2、NO2和水,需要把CO2吸收,且需要把NO2转化为NO,因此首先通入装置C中NO2被吸收同时产生NO。与过氧化钠反应的NO需要干燥,因此利用E装置中的碱石灰吸收水蒸气,同时除去CO2。为防止后面的水进入D装置,需要再次利用E装置,最后利用酸性高锰酸钾溶液吸收尾气,所以实验装置的连接顺序为A、C、E、D、E、B;(2)根据以上分析可知C瓶内发生反应的离子方程式为Cu +2H+ +NO2=Cu2+ +NO+H2O;
(3)①a.酸式滴定管用蒸馏水洗净后未用标准液润洗,会将酸性高锰酸钾溶液稀释,所用体积偏大,测定结果偏高,a正确;b.锥形瓶洗净后未干燥,对滴定结果无影响,b错误;c.滴定终点时仰视读数,所读溶液的体积偏大,测定结果偏高,c正确,答案选ac。②根据表中数据第一次实验数据误差太大,舍去,所用酸性高锰酸钾溶液的体积为20.00mL,根据反应方程式6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O计算25.00mL溶液含亚硝酸钠的物质的量为5×10-3mol,则4.000g样品中含亚硝酸钠的物质的量为0.05mol,质量为3.45g,所得固体中亚硝酸钠的质量分数为3.45g/4.000g×100%=86.25%。(4)酸越弱酸根越容易水解,溶液碱性越强,因此根据弱电解质的电离和盐类水解原理可知实验方案为:25℃时,将两种溶液等体积混合,若混合溶液的pH<7,则说明HNO2的电离程度大于NO2-的水解程度;若pH>7,则说明HNO2的电离程度小于NO2-的水解程度。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案