题目内容
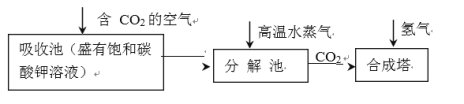
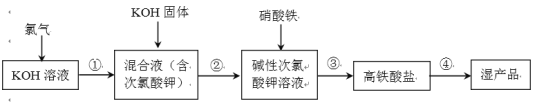
【题目】高铁酸钾(K2FeO4)是一种安全性很高的水处理剂,其合成的部分流程如下。
资料:
ⅰ.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速产生O2,且﹢3价铁能催化该反应。
ⅱ.次氯酸钾容易分解,2KClO![]() 2KCl+O2。
2KCl+O2。
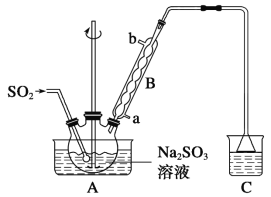
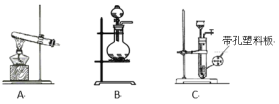
(1)实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的_______。
(2)写出步骤①的离子反应方程式_________________________________ 。
(3)加入KOH固体是为了过滤除盐,过滤除去的是__________________________________。
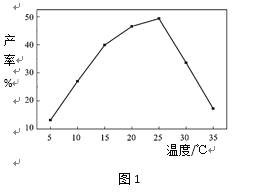
(4)相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示:
请分析高铁酸钾产率随温度变化的原因:________________ 。
(5)相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示:
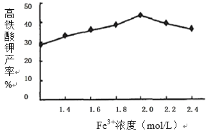
当Fe3+浓度大于2.0mol/L时,高铁酸钾产率变化的原因可能是:_________________________________________。
(6)高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1gMn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为______mol。
【答案】B ![]()
![]() 温度5℃≤T≤25℃时,温度升高速率加快,导致产率逐渐增加;T>25℃时,温度升高,次氯酸钾分解加剧,
温度5℃≤T≤25℃时,温度升高速率加快,导致产率逐渐增加;T>25℃时,温度升高,次氯酸钾分解加剧,![]() 浓度减小,反应速率减慢,导致产率下降 Fe3+的浓度过高催化了K2FeO4分解,导致产率下降 0.012
浓度减小,反应速率减慢,导致产率下降 Fe3+的浓度过高催化了K2FeO4分解,导致产率下降 0.012
【解析】
向KOH溶液中通入Cl2发生歧化反应生成KClO以及KCl,KCl对于后续合成高铁酸钾没有帮助,因此在第二步加入KOH固体时被除去;第三步,向溶液中加入硝酸铁,开始反应生成K2FeO4;题干中指出,高铁酸钾在碱性溶液中较稳定,在酸性溶液中会分解,并且Fe3+会催化该反应,因此,加硝酸铁时,量不能过多,避免Fe3+浓度过高,使K2FeO4分解;题干中还指出,KClO不稳定,因此在步骤三中,温度要控制得当,过低时反应速率太慢,过高时会加剧KClO分解,也不利于制备。
(1)浓盐酸与高锰酸钾反应制备Cl2,由于高锰酸钾易溶于水,所以可以认为是液体反应,因此装置A不可行;装置C中的塑料板也没有阻拦高锰酸钾的作用,C装置也不可行;故应选用B装置;
(2)第一步即向KOH溶液中通Cl2,发生的离子反应方程式为:![]() ;
;
(3)通过分析可知,第二步加KOH目的是除去KCl;
(4)通过分析可知,温度5℃≤T≤25℃时,温度升高速率加快,导致产率逐渐增加;T>25℃时,温度升高,次氯酸钾分解加剧,ClO-浓度减小,反应速率减慢,导致产率下降;
(5)通过分析可知,Fe3+的浓度过高催化了K2FeO4分解,导致产率下降;
(6)由题可知,K2FeO4除Mn(+2价)时,K2FeO4和Mn(+2价)的物质的量之比为2:3;去除率为90%时,水体中的1.1gMn(+2价)被去除了0.018mol,所以消耗的K2FeO4的物质的量为0.012mol。

 优学名师名题系列答案
优学名师名题系列答案