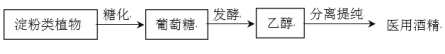
题目内容
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
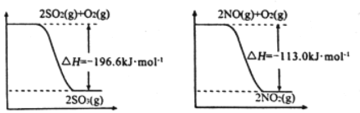
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式:________________;
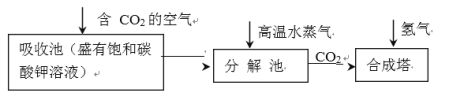
(2)向容积为1 L的密闭容器中分别充入0.1 mol NO2和0.15 mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示:
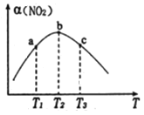
①a、c两点反应速率大小关系:v(a)____v(c)(填“>”“<”或“=”)。若在某温度下达平衡,保持温度、容器的容积不变,再向容器中充入0.2 mol NO2(g)和0.3 mol SO2,NO2的转化率___________(填“增大”“减小”或“不变”);
②在温度小于T2时,NO2的转化率随温度升高而增大的原因是_________;
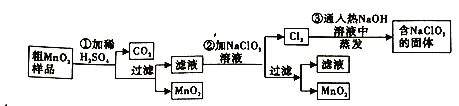
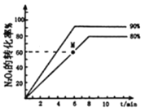
(3)己知可逆反应,N2O4(g)![]() 2NO2(g),v正=k正c(N2O4),v逆=k逆c2(NO2) (k正、k逆只是温度的函数)。向1 L体积固定的密闭容器中充入1 mol N2O4气体分别在T1、T2 (T1>T2)温度下进行该反应。N2O4的转化率与温度、时间的关系如图所示,T1时,该反应的△H____________0(填“>”“<”或“=”),计算M点v正:v逆=_________ (保留到小数点后1位)。
2NO2(g),v正=k正c(N2O4),v逆=k逆c2(NO2) (k正、k逆只是温度的函数)。向1 L体积固定的密闭容器中充入1 mol N2O4气体分别在T1、T2 (T1>T2)温度下进行该反应。N2O4的转化率与温度、时间的关系如图所示,T1时,该反应的△H____________0(填“>”“<”或“=”),计算M点v正:v逆=_________ (保留到小数点后1位)。
【答案】SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H=-41.8 kJ/mol < 不变 温度<T2时,反应正向进行,升高温度,反应速率加快,NO2转化率增大 > 46.1
SO3(g)+NO(g) △H=-41.8 kJ/mol < 不变 温度<T2时,反应正向进行,升高温度,反应速率加快,NO2转化率增大 > 46.1
【解析】
(1)根据图示可得①2SO2(g)+O2(g)![]() 2SO3(g);△H=-196.6 kJ/mol;
2SO3(g);△H=-196.6 kJ/mol;
②O2(g)+2NO(g)=2NO2(g);△H=-113.0 kJ/mol
根据盖斯定律(①②)÷2,整理可得SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H=-41.8 kJ/mol;
SO3(g)+NO(g) △H=-41.8 kJ/mol;
(2)①尽管a点比c点反应物的浓度大,但反应温度c点比a点高,温度对化学反应速率的影响大于浓度对化学反应速率的影响,反应温度越高,化学反应速率越快,所以a、c两点反应速率大小关系:v(a)<v(c);在反应开始时,向容积为1 L的密闭容器中分别充入0.1 mol NO2和0.15 mol SO2,发生反应:SO2(g)+NO2(g)![]() SO3(g)+NO(g),在某温度下达平衡,保持温度、容器的容积不变,再向容器中充入0.2 mol NO2(g)和0.3 mol SO2,由于该反应是反应前后气体体积不变的反应,加入的反应物的物质的量的比相同,增大压强,化学平衡不移动,所以反应NO2的转化率不变;
SO3(g)+NO(g),在某温度下达平衡,保持温度、容器的容积不变,再向容器中充入0.2 mol NO2(g)和0.3 mol SO2,由于该反应是反应前后气体体积不变的反应,加入的反应物的物质的量的比相同,增大压强,化学平衡不移动,所以反应NO2的转化率不变;
②根据图示可知:反应在温度为T2的b点为平衡点,T2以前反应未达到平衡状态,反应正向进行,温度升高,反应速率加快,有更多反应物发生反应转化为生成物,反应物转化率提高;
(3)由于T1>T2,升高温度,化学反应速率加快,且升高温度化学平衡向吸热反应方向移动。根据图示可知在温度为T1时N2O4的转化率较大,说明该反应的正反应为吸热反应,所以△H>0;对于可逆反应,N2O4(g)![]() 2NO2(g) ,反应开始时c(N2O4)=1 mol/L,c(NO2)=0,根据图象可知,在该温度下,平衡时N2O4的转化率为80%,所以平衡时,c(N2O4)=0.2 mol/L,c(NO2)=0.8 mol/L×2=1.6 mol/L,达到平衡时v正= v逆,则k正c(N2O4)=k逆c2(NO2),
2NO2(g) ,反应开始时c(N2O4)=1 mol/L,c(NO2)=0,根据图象可知,在该温度下,平衡时N2O4的转化率为80%,所以平衡时,c(N2O4)=0.2 mol/L,c(NO2)=0.8 mol/L×2=1.6 mol/L,达到平衡时v正= v逆,则k正c(N2O4)=k逆c2(NO2),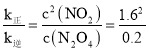 =12.8,在M点时N2O4的转化率为60%,此时c(N2O4)=0.4 mol/L,c(NO2)=0.6 mol/L×2=1.2 mol/L,所以v正:v逆=
=12.8,在M点时N2O4的转化率为60%,此时c(N2O4)=0.4 mol/L,c(NO2)=0.6 mol/L×2=1.2 mol/L,所以v正:v逆= =46.08≈46.1。
=46.08≈46.1。

 阅读快车系列答案
阅读快车系列答案