题目内容
现有浓度均为0.10mol?L-1的醋酸V1 mL和氢氧化钠溶液V2 mL,下列说法正确的是( )
| A、常温下,上述溶液中,醋酸溶液的pH=1,氢氧化钠溶液的pH=13 |
| B、常温下,若两溶液混合后pH=7,则混合液:c(Na+)=c(CH3COO-) |
| C、若 V1=V2,将两溶液混合,所得混合液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、V1与V2任意比混合,所得混合液:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.醋酸为弱电解质,溶液中只能部分电离出氢离子,则醋酸溶液中氢离子浓度小于0.1mol/L,溶液的pH大于1;
B.若溶液的pH=7,则c(H+)=c(OH-),根据溶液中电荷守恒可知:c(Na+)=c(CH3COO-);
C.若 V1=V2,两溶液混合后恰好反应生成醋酸钠,醋酸根离子部分水解,c(CH3COO-)<c(Na+)溶液显示碱性c(H+)<c(OH-);
D.溶液中一定满足电荷守恒,根据电荷守恒进行判断.
B.若溶液的pH=7,则c(H+)=c(OH-),根据溶液中电荷守恒可知:c(Na+)=c(CH3COO-);
C.若 V1=V2,两溶液混合后恰好反应生成醋酸钠,醋酸根离子部分水解,c(CH3COO-)<c(Na+)溶液显示碱性c(H+)<c(OH-);
D.溶液中一定满足电荷守恒,根据电荷守恒进行判断.
解答:
解:A.醋酸为弱电解质,0.10mol?L-1的醋酸中氢离子浓度小于0.1mol/L,则溶液的pH>1,故A错误;
B.常温下,若两溶液混合后pH=7,则c(H+)=c(OH-),根据溶液中电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)=c(CH3COO-),故B正确;
C.当V1=V2时,将两溶液混合后生成醋酸钠溶液,由于醋酸根离子部分水解,则c(CH3COO-)<c(Na+),溶液显示碱性,c(H+)<c(OH-),则所得混合液中离子浓度关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.无论怎样混合,溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故D正确;
故选BD.
B.常温下,若两溶液混合后pH=7,则c(H+)=c(OH-),根据溶液中电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)=c(CH3COO-),故B正确;
C.当V1=V2时,将两溶液混合后生成醋酸钠溶液,由于醋酸根离子部分水解,则c(CH3COO-)<c(Na+),溶液显示碱性,c(H+)<c(OH-),则所得混合液中离子浓度关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.无论怎样混合,溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故D正确;
故选BD.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度大小比较方法,题目难度中等,注意掌握酸碱混合的定性判断方法及溶液酸碱性与溶液pH的计算,能够根据电荷守恒、盐的水解原理等正确判断溶液中离子浓度大小.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
生活中下列处理方法正确的是( )
| A、氯气易液化,液氯可以保存在钢瓶中 |
| B、食盐可作调味剂,不能作食品防腐剂 |
| C、纺织品上的油腻用烧碱溶液清洗 |
| D、把铁器具浸入水隔绝空气防生锈 |
下列物质分类正确的是( )
| A、福尔马林、水玻璃、氨水均为混合物 |
| B、SO2、SiO2、CO均为酸性氧化物 |
| C、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| D、烧碱、冰醋酸、四氯化碳均为电解质 |
下列微粒的表示方法能确定为氧离子的是( )
| A、1S22S22p6 |
B、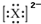 |
C、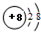 |
D、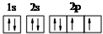 |
下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| C、0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、CH3COONa溶液中c(OH-)=c(CH3COOH)+c(H+) |
已知还原性Cl-<Fe2+<I-<SO2,则下列反应不能发生的是( )
| A、2Fe2++I2═2Fe3++2I- |
| B、I2+SO2+2H2O═H2SO4+2HI |
| C、2Fe3++2I-═2Fe2++I2 |
| D、Cl2+2Fe2+═2Fe3++2Cl- |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,48g O3含有氧原子数为NA |
| B、12g NaHSO4在熔融时离子总数为0.3NA |
| C、氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子 |
| D、7.8g Na2O2中含有阴离子数为0.1NA |
标况下,在五个烧瓶中分别充入①纯净的氨气②混有
空气的HCl③纯净的NO2④NO2与O2体积比4:1⑤NO与O2体积比4:3.然后做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
| 1 |
| 5 |
| A、①=②=③=④=⑤ |
| B、①=②=③>④>⑤ |
| C、①=②=③>⑤>④ |
| D、①>③>②>⑤>④ |
当0.2mol Na218O2与足量CO2完全反应后所得固体的质量为( )
| A、21.2g |
| B、21.6g |
| C、22.0g |
| D、22.4g |