题目内容
13.工业生产甲醇的常用方法是:CO(g)+2H2(g)?CH3OH(g)△H1=-90.8kJ/mol.已知:2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol;2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ/mol;计算2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H4=-1527.6KJ/mol.
分析 已知:CO(g)+2H2(g)?CH3OH(g)△H1=-90.8kJ/mol ①;
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol ②;
2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ/mol③.
结合目标反应,利用盖斯定律将所给的反应做相应的变形,反应热做相应的变化即可,据此分析.
解答 解:已知:CO(g)+2H2(g)?CH3OH(g)△H1=-90.8kJ/mol ①;
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol ②;
2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ/mol③.
将③+②×2-①×2可得:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H4=△H3+2△H2-2△H1=-1527.6KJ/mol,
故答案为:-1527.6KJ/mol.
点评 本题考查了反应热的计算、盖斯定律的应用、热化学方程式的书写,题目难度不大,注意把握盖斯定律的含义和热化学方程式的书写要求.

练习册系列答案
相关题目
3.下列关于化学反应的说法中不正确的是( )
| A. | 化学反应的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 分解反应都是吸热反应,化合反应都是放热反应 | |
| C. | 若反应放热,则反应物的总能量大于生成物的总能量 | |
| D. | 利用化学反应可以合成自然界中不存在的物质 |
4.化学学科需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 基态铜原子的价电子排布图: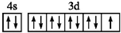 | |
| B. | CO2分子立体结构模型: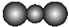 | |
| C. | 三氟化硼的电子式: | |
| D. | 35Br基态原子的电子排布式可简写为[Ar]4s24p5 |
18.如图为元素周期表中短周期主族非金属元素的一部分,下列说法不正确的是( )


| A. | W的原子序数可能是Y的两倍 | |
| B. | Z的原子半径比X的大 | |
| C. | Y元素的非金属性比Z元素的强 | |
| D. | Z的最高价氧化物对应的水化物的酸性比W的强 |
11.无水氯化铝是白色晶体,露置在空气中极易水解,在178℃升华,装有无水氯化铝试剂瓶露置空气中,会产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂.如图是实验室制取氯气并用于制取少量无水氯化铝的装置的仪器和药品.可供选用的试剂如下:
A.饱和食盐水 B.水 C.浓H2SO4 D.碱石灰 E.铝粉 F.二氧化锰 G.浓盐酸 H.烧碱溶液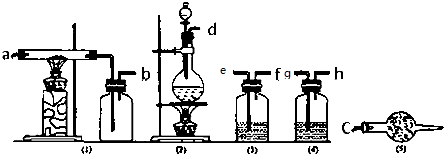
回答下列问题:(1)写出AlCl3露置在空气中生成白雾的化学方程式:AlCl3+3H2O?Al(OH)3+3HCl.
(2)从上述仪器中选取若干连成一制备并保存无水AlCl3的装置,用图中各管口标号按先后可连接为:d接e,f接g,h接a,b接c.
(3)填写连接装置中各选用仪器里应盛放的物质:
(4)设计使用(5)仪器和药品有两个主要作用是:防止空气中的水分进入(1)中和吸收剩余氯气防止空气污染.
A.饱和食盐水 B.水 C.浓H2SO4 D.碱石灰 E.铝粉 F.二氧化锰 G.浓盐酸 H.烧碱溶液

回答下列问题:(1)写出AlCl3露置在空气中生成白雾的化学方程式:AlCl3+3H2O?Al(OH)3+3HCl.
(2)从上述仪器中选取若干连成一制备并保存无水AlCl3的装置,用图中各管口标号按先后可连接为:d接e,f接g,h接a,b接c.
(3)填写连接装置中各选用仪器里应盛放的物质:
| 仪器标号 | (1) | (2)(上) | (2)(下) | (3) | (4) | (5) |
| 试剂标号 | G | F |