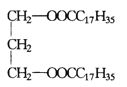题目内容
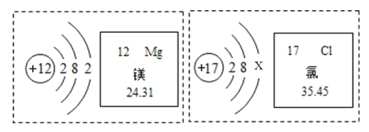
【题目】(1)用A质子数,B中子数,C核外电子数,D最外层电子数,用序号回答下列问题。
①原子种类由______决定;
②元素种类由______决定;
③元素的化合价由______决定。
(2)2.0g由![]() 和
和![]() 构成的水
构成的水![]() ,该水分子的物质的量为______,含中子数为______。
,该水分子的物质的量为______,含中子数为______。
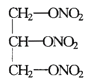
(3)核内中子数为N的![]() ,质量数为A,则该离子的核外电子数为______。
,质量数为A,则该离子的核外电子数为______。
【答案】AB A D 0.1mol ![]() 或
或![]()
![]()
【解析】
(1)①原子是具有一定数目质子和一定数目中子的一种原子,原子种类由质子数和中子数决定;
②元素是具有相同核内质子数![]() 或核电荷数
或核电荷数![]() 的一类原子的总称,由质子数决定;
的一类原子的总称,由质子数决定;
③化学性质主要由价电子决定,而主族元素价电子一般就是最外层电子,而副族元素大多还包括次外层的一些电子;
(2)根据![]() 计算可得;
计算可得;
(3)对应微粒![]() 来说,质量数
来说,质量数![]() 质子数
质子数![]() 中子数,核外电子数
中子数,核外电子数![]() 质子数
质子数![]() 所带电荷数。
所带电荷数。
(1)①原子是具有一定数目质子和一定数目中子的一种原子,原子种类由质子数和中子数决定,故答案为:AB;
②元素是具有相同核内质子数![]() 或核电荷数
或核电荷数![]() 的一类原子的总称,由质子数决定,故答案为:A;
的一类原子的总称,由质子数决定,故答案为:A;
③化学性质主要由价电子决定,而主族元素价电子一般就是最外层电子,而副族元素大多还包括次外层的一些电子,故答案为:D;
(2)![]() 的摩尔质量为
的摩尔质量为![]() ,
,![]() 的物质的量
的物质的量![]() ,分子含有中子数为
,分子含有中子数为![]() ,故含有的中子数目为
,故含有的中子数目为![]() 或
或![]() ,故答案为:
,故答案为:![]() ;
;![]() 或
或![]() ;
;
(3)对应微粒![]() 来说,质量数
来说,质量数![]() 质子数
质子数![]() 中子数,核外电子数
中子数,核外电子数![]() 质子数
质子数![]() 所带电荷数,所以该离子的核外电子数
所带电荷数,所以该离子的核外电子数![]() 质量数
质量数![]() 中子数
中子数![]() 所带电荷数
所带电荷数![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】碱式碳酸铋片[主要成分(BiO)2CO3]可用于治疗慢性胃炎及缓解胃酸过多引起的胃病。由菱铋矿(主要成分为nBi2O3·mCO2·H2O,含杂质SiO2、CuS等)制备(BiO)2CO3的一种工艺如图:

试回答下列问题:
(1)为提高①的“酸溶”速率,可以采取的措施是__________(任写一种)。
(2)①中酸溶解率与接触时间及溶液的pH之间的关系如图,据此分析,“酸溶”的最佳条件为__________;滤渣的主要成分是__________。
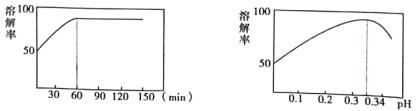
(3)“酸溶”后溶液必须保持强酸性,以防止铋元素流失,原理是__________。
(4)②中得到“海绵铋”的离子方程式为__________。
(5)④中反应的化学反应方程式为__________。
(6)25℃时,向浓度均为0.1mol·L-1的Fe2+、Cu2+、Bi3+的混合溶液中滴加Na2S溶液,当Fe2+恰好沉淀完全时,所得溶液c(Cu2+):c(Bi3+)=__________。(忽略Na2S溶液所带来的体积变化)。
资料:①有关溶度积数据见表:
难溶物质 | FeS | CuS | Bi2S3 |
Ksp(25℃) | 6.3×10-18 | 6.3×10-36 | 1.6×10-20 |
②溶液中的离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
【题目】某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的: ______
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
仪器:① ______ ;② ______ ![]() 请填写两件主要的玻璃仪器
请填写两件主要的玻璃仪器![]()
(3)实验内容:
序号 | 实验方案 | 实验现象 |
① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层 |
② | 将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层 |
(4)实验结论: ______ .
(5)问题和讨论:请用结构理论简单说明得出上述结论的原因. ______ .