题目内容
7.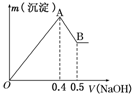 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 6:1 |
分析 依据图中关系可知,加入氢氧化钠溶液0.4体积时,发生反应AlCl3~Al(OH)3↓、MgSO4~Mg(OH)2↓,则0.4V~0.5体积时NaOH发生了NaOH与氢氧化铝的反应,由铝原子守恒可判断原溶液中的铝离子,即得出氯离子的量,依据0~0.4V氢氧化钠溶液时发生反应AlCl3~Al(OH)3↓、MgSO4~Mg(OH)2↓,求出Mg2+的量,进而得到SO42-的物质的量,据此解答.
解答 解:第一条上升的直线是表示AlCl3和MgSO4一起产生沉淀,第二条下降的直线表示Al(OH)3沉淀溶解,设氢氧化钠溶液的浓度为c,根据Al(OH)3+OH-═AlO2-+2H2O,第二条直线可知加入0.1V体积的NaOH将氢氧化铝完全溶解,可知AlCl3是0.1cVmol,则氯离子的物质的量为0.3cVmol,再根据Al3++3OH-═Al(OH)3↓,由这些氯化铝完全沉淀消耗氢氧化钠0.3V体积;
再根据第一条直线可知,0.4V-0.3V=0.1V体积的氢氧化钠将镁离子全部沉淀,而Mg2++2OH-═Mg(OH)2↓,所以MgSO4为0.05cVmol,所以硫酸根离子的物质的量为0.05cVmol,
所以原溶液中Cl-与SO42-的物质的量之比为0.3cVmol:0.05cVmol=6:1,
故选:D.
点评 本题考查了有关离子方程式的计算,明确图中各段发生的离子反应是解题关键,注意氢氧化铝的两性,题目难度中等.

练习册系列答案
相关题目
8.下列电离方程式或水解方程式中,错误的是( )
| A. | Na2CO3+2H2O?H2CO3+2NaOH | B. | NH3•H20?NH4++OH- | ||
| C. | CH3COOH?H++CH3COO- | D. | Na2SO3+H2O?NaHS03+NaOH |
15.下列说法不正确的是( )
| A. | 只有碳、氢两种元素组成的有机化合物称为烃 | |
| B. | 乙醛和乙酸都含有碳氧双键,二者都能发生加成反应 | |
| C. | 苯可以发生加成反应,但苯中不含有碳碳双键 | |
| D. | 乙醇和苯酚都含有羟基都能发生酯化反应 |
12.下列化合物中,只含有离子键的是( )
| A. | KOH | B. | NH3 | C. | H2O | D. | CaCl2 |
19.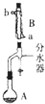 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
物质的相关数据如下表:
(1)制备乙酸正丁酯
①在干燥的50ml圆底烧瓶中,加入3.7g的正丁醇和3.3g冰醋酸,再加入2~3滴浓硫酸,摇匀,投入1~2粒沸石 按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用适量的水洗涤.有机层继续用一定体积10%Na2CO3洗涤至中性,再用适量的水洗涤,最后将有机层转移至锥形瓶中,再加入少量无水硫酸镁固体.静置片刻,过滤除去硫酸镁固体.
③将②处理后的乙酸正丁酯滤入50 mL 烧瓶中,进行蒸馏纯化,收集126.1℃的馏分,得乙酸正丁酯3.5g.
回答有关问题:
(1)装置B的名称是球形冷凝管
(2)步骤①中判断反应终点的依据是分水器中的水层不再增加时,视为反应的终点
(3)产品的精制过程步骤②中,第一次水洗的目的是洗去大部分的硫酸和醋酸等用饱和Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的残留酸等杂质第二次洗的目的是洗去乙酸正丁酯中的盐分实验中加入少量无水硫酸镁的目的是干燥
(4)下列关于蒸馏操作的说法,正确的是B
A、温度计的水银柱应插入到液面以下
B、蒸馏过程中,加入沸石(碎瓷片)的目的是防止暴沸
C、冷凝管进出水的方向是上进下出
D、为提高蒸馏的速度,可以不用石棉网而直接用酒精灯进行加热.
(5)步骤③的常压蒸馏,需收126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,列式计算生成乙酸正丁酯的产率(保留2位有效数字)60%.
 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
物质的相关数据如下表:
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50ml圆底烧瓶中,加入3.7g的正丁醇和3.3g冰醋酸,再加入2~3滴浓硫酸,摇匀,投入1~2粒沸石 按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用适量的水洗涤.有机层继续用一定体积10%Na2CO3洗涤至中性,再用适量的水洗涤,最后将有机层转移至锥形瓶中,再加入少量无水硫酸镁固体.静置片刻,过滤除去硫酸镁固体.
③将②处理后的乙酸正丁酯滤入50 mL 烧瓶中,进行蒸馏纯化,收集126.1℃的馏分,得乙酸正丁酯3.5g.
回答有关问题:
(1)装置B的名称是球形冷凝管
(2)步骤①中判断反应终点的依据是分水器中的水层不再增加时,视为反应的终点
(3)产品的精制过程步骤②中,第一次水洗的目的是洗去大部分的硫酸和醋酸等用饱和Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的残留酸等杂质第二次洗的目的是洗去乙酸正丁酯中的盐分实验中加入少量无水硫酸镁的目的是干燥
(4)下列关于蒸馏操作的说法,正确的是B
A、温度计的水银柱应插入到液面以下
B、蒸馏过程中,加入沸石(碎瓷片)的目的是防止暴沸
C、冷凝管进出水的方向是上进下出
D、为提高蒸馏的速度,可以不用石棉网而直接用酒精灯进行加热.
(5)步骤③的常压蒸馏,需收126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,列式计算生成乙酸正丁酯的产率(保留2位有效数字)60%.
16.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是 ( )
| A. | 可根据同周期元素的第一电离能变化规律,推出Al的第一电离能比Mg大 | |
| B. | 结构和组成相似的分子晶体,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据溶解度小的沉淀易向溶解度更小的沉淀转化的规律,推出在ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
17.欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星--土卫六.科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其它碳氢化合物.下列关于碳氢化合物的叙述正确的是( )
| A. | 碳氢化合物的通式为CnH2n+2 | B. | 芳香烃属于碳氢化合物 | ||
| C. | 乙炔是含碳量最高的碳氢化合物 | D. | 溴苯属于碳氢化合物 |

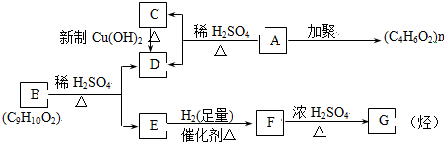
 ;
;
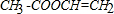 ,B:
,B: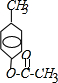 ;
;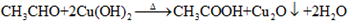 ,
,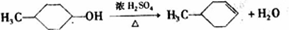 .
.