题目内容
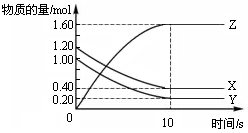
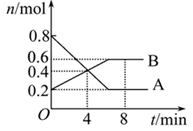
(8分)某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
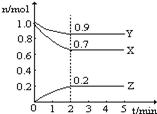
(1)该反应的化学方程式为 ______ __ 。
(2)该反应是由 开始的。(①正反应 ②逆反应 ③正逆反应同时。)
(3)该反应第 ______ 分钟到达平衡状态。
(4)反应开始至3 min,气体X的平均反应速率为 _______。

(1)该反应的化学方程式为 ______ __ 。
(2)该反应是由 开始的。(①正反应 ②逆反应 ③正逆反应同时。)
(3)该反应第 ______ 分钟到达平衡状态。
(4)反应开始至3 min,气体X的平均反应速率为 _______。
(1) 3X+Y  2Z (2)①正反应 (2分)
2Z (2)①正反应 (2分)
(3) 2 (2分) (2分) (4)0.05 mol/(L·min) (2分)
 2Z (2)①正反应 (2分)
2Z (2)①正反应 (2分)(3) 2 (2分) (2分) (4)0.05 mol/(L·min) (2分)
试题分析:(1)由图知,X、Y的物质的量分别减少0.3mol、0.1mol,说明X、Y是反应物;Z的物质的量增加0.2mol,Z是生成物;根据化学方程式中各物质的物质的量的改变量之比等于化学计量数之比,所以该反应的化学方程式为3X+Y
 2Z ;
2Z ;(2)开始时Z的物质的量是0mol,所以该反应是由①正反应开始的。
(3)第2min时各物质的物质的量不再改变,达到平衡状态;
(4)反应开始至3 min,气体X的浓度减小(1-0.7)mol/2L=0.15mol/L,v(X)=△c/t=0.15mol/L/3min=0.05 mol/(L·min)

练习册系列答案
相关题目
 X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下: 1
1

 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1

 2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。 时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。 (气体体积均在标准状况下测定)。请回答下列问题:
(气体体积均在标准状况下测定)。请回答下列问题: (3)加入CaCO3的质量为 。
(3)加入CaCO3的质量为 。