题目内容
(8分)某温度时,在0.5L密闭容器中某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
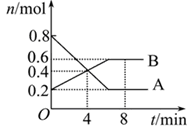
(1)该反应的化学方程式为______________________________。
(2)反应开始至4min时,B的平均反应速率为____________。
(3)平衡时A的转化率为________。第4min时,正逆反应速率的大小关系为:υ(正)___υ(逆)(填“>”、“<”或“=”,下同),第8min时,υ(正)___υ(逆)。

(1)该反应的化学方程式为______________________________。
(2)反应开始至4min时,B的平均反应速率为____________。
(3)平衡时A的转化率为________。第4min时,正逆反应速率的大小关系为:υ(正)___υ(逆)(填“>”、“<”或“=”,下同),第8min时,υ(正)___υ(逆)。
(1)3A 2B (2分)(2)0.1mol/(L?min)(2分)
2B (2分)(2)0.1mol/(L?min)(2分)
(3) 75% ( 2分 ) > (1分) = (1分)
 2B (2分)(2)0.1mol/(L?min)(2分)
2B (2分)(2)0.1mol/(L?min)(2分)(3) 75% ( 2分 ) > (1分) = (1分)
试题分析:(1)根据图像可知反应进行到8min时A的物质的量减少了0.8mol-0.2mol=0.6mol,B的物质的量增加了0.6mol-0.2mol=0.3mol,所以根据变化量之比是相应的化学计量数之比可知反应物A和生成物B的化学计量数之比是3;2,因此反应的化学方程式为3A
 2B。
2B。(2)反应开始至4min时,B的物质的量增加了0.4mol-0.2mol=0.2mol,其浓度是0.2mol÷0.5L=0.4mol/L,所以B的平均反应速率为0.4mol/L÷4min=0.1mol/(L?min)。
(3)根据图像可知平衡时消耗A的物质的量是0.6mol,所以A的转化率为
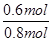 ×100%=75%。第4min时,反应没有达到平衡状态,此时向正反应方向进行,正逆反应速率的大小关系为:υ(正) >υ(逆),第8min时正逆反应速率相等,反应达到平衡状态。则υ(正)=υ(逆)。
×100%=75%。第4min时,反应没有达到平衡状态,此时向正反应方向进行,正逆反应速率的大小关系为:υ(正) >υ(逆),第8min时正逆反应速率相等,反应达到平衡状态。则υ(正)=υ(逆)。
练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目

 HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。

 AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应:
 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)