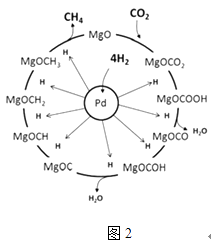
题目内容
【题目】(1)某无色溶液只含有Na+、Ba2+、Al3+、Fe3+、Br-、SO42-、CO32-中两种或多种离子,取少量逐滴滴入NaOH溶液至过量,先出现白色沉淀后消失的现象;另取少量往其中滴加氯水,溶液为橙黄色;则原溶液一定不存在__________(填离子符号)。写出原溶液加入过量的NaOH溶液反应的离子方程式_______________。
(2)KClO3和浓盐酸在一定温度下的化学方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。浓盐酸在反应中表现出来的性质是__________(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性。
反应中,若氧化产物比还原产物多0.1mol,则电子转移的物质的量为__________mol。
【答案】 Fe3+、CO32- Al3++ 4OH- === AlO2- +2H2O ② 0.25。
【解析】(1)溶液无色,则一定不存在Fe3+;取少量逐滴滴入NaOH溶液至过量,先出现白色沉淀后消失的现象,因此一定存在Al3+,所以不能存在CO32-;另取少量往其中滴加氯水,溶液为橙黄色,即有溴单质生成,所以一定存在Br-,Na+、Ba2+、SO42-不能确定,但Ba2+、SO42-不钠同时存在,因此原溶液一定不存在Fe3+、CO32-,原溶液加入过量的NaOH溶液反应的离子方程式为Al3++ 4OH-=AlO2-+2H2O;(2)盐酸中氯元素化合价升高,失去电子,同时还有氯化钾生成,则浓盐酸在反应中表现出来的性质是酸性和还原性,答案选②;氯酸钾中氯元素化合价从+5价降低到0价,这说明氯气既是氧化产物,也是还原产物,根据电子得失守恒可知还原产物和氧化产物的物质的量之比是1:5。反应中,若氧化产物比还原产物多0.1mol,如果设还原产物的物质的量是xmol,则氧化产物的物质的量是0.1mol+xmol,所以有![]() ,解得x=0.025,则电子转移的物质的量为0.025mol×5×2=0.25mol。
,解得x=0.025,则电子转移的物质的量为0.025mol×5×2=0.25mol。

【题目】镍是重要的有色金属之一,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用.现对粗镍进行提纯,具体的反应流程如下: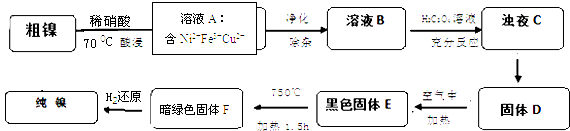
已知:
①2Ni2O3(黑色) ![]() 4NiO(黑色)+O2↑
4NiO(黑色)+O2↑
②
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
Ksp | 8.8×10﹣38 | 2.2×10﹣20 | 5.48×10﹣18 | 3.2×1018 |
根据信息回答:
(1)28Ni在周期表中的第周期;镍与稀硝酸反应的离子方程式为 . 实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3 . 为了得到纯净的溶液B还需要加入以下物质进行除杂(填正确答案标号).
A.NaOH
B.Na2S
C.H2S
D.NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4H2O>NiC2O42H2O.由浊液C得到固体D的操作包括过滤、、(填操作名称); D生成E的化学方程式为
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32﹣ , C2O42﹣、S2﹣等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为: .