题目内容
【题目】下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀. 
请回答下列问题:
(1)B中所含元素位于周期表中第周期,族.
(2)A在B中燃烧的现象是 .
(3)D+E→B的反应中,被氧化与被还原的物质的物质的量比是 .
(4)G+J→M的离子方程式是 .
(5)Y受热分解的化学方程式是 .
【答案】
(1)三;ⅦA
(2)气体安静燃烧,火焰呈苍白色,并有白雾产生
(3)2:1
(4)3AlO2﹣+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓
(5)4Fe(NO3)3 ![]() 2Fe2O3+12NO2↑+3O2↑
2Fe2O3+12NO2↑+3O2↑
【解析】解:F是地壳中含量最多的金属元素的单质,则F为Al;转化关系中X电解得到三种物质,为电解电解质与水型,A、B为气态单质,二者为氢气和氯气,二者反应生成D,D为HCl,E为黑色固体,为氧化物,和HCl反应又生成B气体,A为H2 , B为Cl2 , E为MnO2 , 电解X是电解氯化钠溶液,C为NaOH,与Al反应生成G,G为NaAlO2;M为红褐色沉淀为Fe(OH)3 , 所以J是含三价铁离子的物质,是H和D反应生成,证明J为FeCl3 , H、I为氧化物判断H为Fe2O3 , I为红棕色气体为NO2 , 结合转化故选可知,N为HNO3 , Y为Fe(NO3)3.
(1.)B为Cl2中所含元素位于周期表第三周期第ⅦA族,所以答案是:三;ⅦA;
(2.)A为H2 , B为Cl2 , 氢气在氯气燃烧的现象是:气体安静燃烧,火焰呈苍白色,并有白雾产生,所以答案是:气体安静燃烧,火焰呈苍白色,并有白雾产生;
(3.)D+E→B的反应为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,n(被氧化的物质HCl):n(被还原的物质MnO2)=2:1,所以答案是:2:1;
MnCl2+Cl2↑+2H2O,n(被氧化的物质HCl):n(被还原的物质MnO2)=2:1,所以答案是:2:1;
(4.)G(NaAlO2)+J(FeCl3)→M(Fe(OH)3)的反应是在水溶液中发生的双水解反应,反应离子方程式是:3AlO2﹣+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓,所以答案是:3AlO2﹣+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓;
(5.)依据分析推断可知Y为Fe(NO3)3 , 受热分解生成二氧化氮和氧化铁,依据原子守恒配平书写的化学方程式是:4Fe(NO3)3 ![]() 2Fe2O3+12NO2↑+3O2↑,
2Fe2O3+12NO2↑+3O2↑,
所以答案是:4Fe(NO3)3 ![]() 2Fe2O3+12NO2↑+3O2↑.
2Fe2O3+12NO2↑+3O2↑.

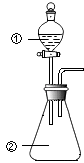
【题目】用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.A
B.B
C.C
D.D