题目内容
【题目】CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义.利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为: ①CH4(g)═C(s)+2H2(g)△H=75.0kJmol﹣1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=41.0kJmol﹣1
③CO(g)+H2(g)═C(s)+H2O(g)△H=﹣131.0kJmol﹣1
(1)反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的△H= .
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图1. 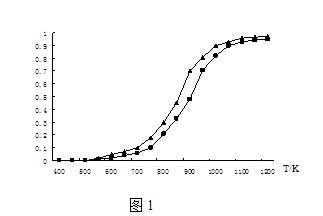
①同温度下CO2的平衡转化率(填“大于”或“小于”)于CH4的平衡转化率,其原因是 .
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是 .
(3)一定条件下Pd﹣Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图2所示,该反应的化学方程式为 , 反应过程中碳元素的化合价为﹣2价的中间体是 . 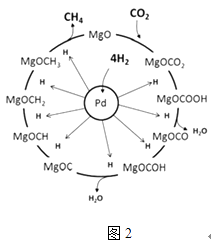
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4+Na2CO3═CaCO3+Na2SO4 , 则达到平衡后,溶液中 ![]() = . [用Ksp(CaSO4)和Ksp(CaCO3)表示].
= . [用Ksp(CaSO4)和Ksp(CaCO3)表示].
【答案】
(1)+247kJ?mol﹣1
(2)大于;CO2发生了其他副反应;该反应△H>0,△S>0,高温时△G=△H﹣T△S<0
(3)CO2+4H2═CH4+2H2O;MgOCH2
(4)![]()
【解析】解:(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol③CO(g)+H2(g)═C(s)+H2O(g)△H=﹣131.0kJ/mol反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②﹣③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,所以答案是:+247kJ/mol;(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;所以答案是:大于;CO2发生了其他副反应;②反应自发进行的判据:△H﹣T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,所以答案是:该反应△H>0,△S>0,高温时△G=△H﹣T△S<0;(3)据信息:一定条件下Pd﹣Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2=CH4+2H2O;反应过程中碳元素的化合价为﹣2价的中间体是MgOCH2;所以答案是:CO2+4H2=CH4+2H2O;MgOCH2;(4)达到平衡后,Ksp(CaCO3)=c(Ca2+)c(CO32﹣),Ksp(CaSO4)=c(Ca2+)c(SO42﹣),在 ![]() 分子和分母同乘以钙离子的浓度,所以溶液中
分子和分母同乘以钙离子的浓度,所以溶液中 ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() .
.
【考点精析】本题主要考查了反应热和焓变和化学平衡的计算的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.