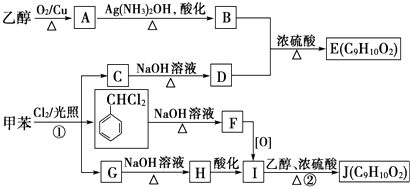
题目内容
【题目】某温度下,在密闭容器中进行SO2的催化氧化反应.若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则下列叙述中正确的是( )
A.SO2的转化率为60%
B.SO3的产率为60%
C.平衡时总压强与起始压强之比为7:8
D.平衡时V(SO2):V(O2):V(SO3)=3:3:1
【答案】C
【解析】解:若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则
2SO2+ | O2 | 2SO3 | |
开始 | 6 | 6 | 0 |
转化 | 3 | 1.5 | 3 |
平衡 | 3 | 4.5 | 3 |
A.SO2的转化率为 ![]() =50%,故A错误;
=50%,故A错误;
B.理论上完全转化生成SO3的浓度为6mol/L,则产率为 ![]() =50%,故B错误;
=50%,故B错误;
C.平衡时总压强与起始压强之比为 ![]() =7:8,故C正确;
=7:8,故C正确;
D.平衡时V(SO2):V(O2):V(SO3)=3:4.5:3=2:3:2,故D错误;
故选C.
若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则
2SO2+ | O2 | 2SO3 | |
开始 | 6 | 6 | 0 |
转化 | 3 | 1.5 | 3 |
平衡 | 3 | 4.5 | 3 |
结合转化率= ![]() ×100%及物质的量比等于压强比计算.
×100%及物质的量比等于压强比计算.

练习册系列答案
相关题目