��Ŀ����
����Ŀ����֪NO2��N2O4�����ת����2NO2��g��N2O4��g����H��0���ں��������½�һ����NO2��N2O4�Ļ������ͨ��һ�ݻ�Ϊ2L���ܱ������У���Ӧ��Ũ����ʱ��仯��ϵ��ͼ������˵������ȷ���ǣ� �� 
A.ͼ�е��������ߣ�X��ʾNO2Ũ����ʱ��ı仯����
B.ǰ10 min����v��N2O4��=0.02 mol/��Lmin��
C.25 minʱ��NO2ת��ΪN2O4�ķ�Ӧ����������ԭ ���ǽ��ܱ������������СΪ1L
D.���¶��·�Ӧ��ƽ�ⳣ�� K=1.11 L/mol
���𰸡�C
���������⣺��ͼ��֪10��25minƽ��״̬ʱ��X��ʾ���������Ũ�ȱ仯��Ϊ��0.6��0.2��mol/L=0.4mol/L��Y��ʾ�ķ�Ӧ���Ũ�ȱ仯��Ϊ��0.6��0.4��mol/L=0.2mol/L��X��ʾ���������Ũ�ȱ仯����Y��ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ�A��������������֪��X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ���A��ȷ��
B����ͼ���֪��10 min����N2O4��Ũ�ȱ仯��Ϊ��0.6��0.4��mol/L=0.2mol/L����v��N2O4��= ![]() =0.02 mol/��Lmin������B��ȷ��
=0.02 mol/��Lmin������B��ȷ��
C��25minʱ��X��Ũ������Y��Ũ�Ȳ��䣬ֻ��������X��Ũ�ȣ��������߷����仯��ԭ��������NO2Ũ�ȣ���C����
D����Ӧ2NO2��g��N2O4��g����0��10min��v��NO2��=0.6molL��1 �� v��N2O4��=0.4molL��1 �� K= ![]() =
= ![]() =
= ![]() =1.11L/mol���¶Ȳ��䣬k���䣬��D��ȷ��
=1.11L/mol���¶Ȳ��䣬k���䣬��D��ȷ��
��ѡC��
��ͼ��֪10��25minƽ��״̬ʱ��X��ʾ���������Ũ�ȱ仯��Ϊ��0.6��0.2��mol/L=0.4mol/L��Y��ʾ�ķ�Ӧ���Ũ�ȱ仯��Ϊ��0.6��0.4��mol/L=0.2mol/L��X��ʾ���������Ũ�ȱ仯����Y��ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ�
A������X��Y��Ũ�ȱ仯��������Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ�ȷ����ʾNO2Ũ�ȱ仯���ߣ�
B����ͼ���֪��10 min����������������Ũ�ȱ仯��Ϊ��0.6��0.2��mol/L=0.4mol/L������v= ![]() ����v��N2O4����
����v��N2O4����
C��25minʱ��X��Ũ������Y��Ũ�Ȳ��䣬ֻ��������X��Ũ�ȣ�
D��K���¶��йأ�����ͼ�����ƽ��ʱ��Ũ�ȣ��ٸ���K�ı���ʽ���K��

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�����Ŀ������ͪ����ͼ1����һ����Ҫ�Ļ���ԭ�ϣ�ʵ���ҳ�������ԭ����װ���Ʊ������ּг�����δ����������ͼ2����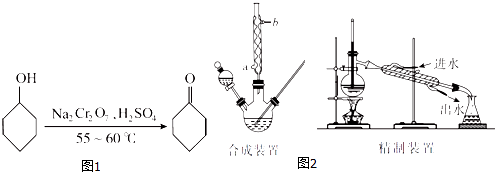
������������ͪ��ˮ�IJ����������ʼ��±���*�����е����ݱ�ʾ���л�����ˮ�γɵľ��й̶���ɵĻ����ķе㣩��
���� | ��Է������� | �е㣨�棩 | �ܶȣ�gcm��3 �� 20�棩 | �ܽ��� |
������ | 100 | 161.1��97.8�� | 0.9624 | ������ˮ |
����ͪ | 98 | 155.6��95�� | 0.9478 | ����ˮ |
ˮ | 18 | 100.0 | 0.9982 |
��1����֪�ϳɻ���ͪ�ķ�Ӧ�Ƿ��ȷ�Ӧ����Ӧ���ҽ�������ϵ�¶�Ѹ������������Ӧ���࣮ʵ��ʱ�����ںϳ�װ���м���5.2 mL��5 g���������ͼ�����ʯ���ټ�������Na2Cr2O7��Һ������Na2Cr2O7��Һ�ļ��Ϸ�ʽΪ������ţ���
A.һ���Լ���
B.��������
C.����ν���������붼����
��2��������Na2Cr2O7��Һ�����Ϊ35 mL����Ӧѡȡ���100 mL����250mL����������ƿ��
��3����Ӧ��ɺ�������ˮ�������ռ�95��100�����֣���ΪA��������Ҫ�ɷ����Ļ���
��4���ϳ�װ���������ܵ������� �� ����ˮ�������ܵ����a����b�����ڽ��룮
��5�������A�м����Ȼ��ƹ��������ͣ������á���Һ�����л��㣨��ΪB���������Ȼ��ƹ���������� ��
��6�����л���B�м�����ˮ����þ���壬��ȥ���е�����ˮ�֣����ˣ�����Һ���ھ���װ���������ռ�������ţ�����֣��õ������Ļ���ͪ��
A.100.0��102.0��
B.154.0��156.0��
C.160.0��162.0��
��7������װ���еĴ����� �� ����дһ�㣩
��8�������յõ�����ͪ������Ϊ3.43 g����ͪ�IJ����� ��
����Ŀ��������������з�����ɫ��չ�����ÿɳ�����չ�������й�����
��1������һ����Ҫ����ԭ�ϣ��ϳɰ�ԭ����H2 �� ������Ȼ��Ϊԭ���Ƶã��йط�Ӧ�����仯��ͼ1��ʾ������CH4��g����H20��g����Ӧ�Ƶ�H2��g����CO��g�����Ȼ�ѧ����ʽΪ��
��2���������������Ź㷺��;�����ǻ�������Ⱦ���i����150��ʱ����0.4mol NO2����������Ϊ2L������ܱ������У�������Ӧ��2NO2��g��N2O4��g����
ÿ��һ��ʱ��ⶨ�����ڸ����ʵ����ʵ������������±���
ʱ��/S | 0 | 20 | 40 | 60 | 80 |
N��NO2��/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N��N2O4��/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
�ٵ���Ӧ��150��ﵽƽ��ʱ���÷�Ӧƽ�ⳣ��K= �� ������ֵ��
�������ͨ��N2O4 �� ����ͬ�����´ﵽƽ��ʱ��������Ũ����Ȼ��ͬ����N2O4����ʼŨ��
ӦΪ ��
��ii����������HNO3��β���к���NO��NO2 �� ��n��NO����n��NO2��=1��1������������Һ��ȥ��������ԭ���ǣ�NO2��NO��ˮ��Ӧ���������ᣬ��������������[CO�� NH2��2]��Ӧ���ɶԻ�������
Ⱦ�����ʣ�����1mol�������ո�β�����������յ�������g��
��3��������CO2��һ�������¿ɺϳ����أ��䷴ӦΪ��2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��g��ͼ2��ʾ�ϳ����а�̼��a��CO2ת���ʦصĹ�ϵ��aΪ[n��NH3����n��CO2��]��bΪˮ̼��[n��H2O����n��CO2��]����
��bӦ��������
A.1.5��1.6 B.1��1.1 C.0.6��0.7
��aӦ������4.0�������� ��
����Ŀ���й���ѧԺ�ٷ�����2017��3�·���������ר�⡷�����������ϸ������ij����ַ�������ͼ��ʾ��

��1��������ͼ��Ϣ���Կ�������������������Ⱦ�������ɻ�������ʻ��ɵ�_____��
a��SO2 b��NOx c��VOCs d�� NH3
��2��������������ʻ����ȾԴ֮һ����������������ϡȼ����ϵͳ��Ҫ����ԭ����ͼ��ʾ��д��ϡȼ������NO��������Ҫ��Ӧ�ķ���ʽ_______��

��3��SO2��������Ⱦ�����Ҫ�ɷ�֮һ����Ϊһ�ֻ�ѧ���ʻ��õ����ʣ����ܷ������ַ�Ӧ���밴���±���ʾ���Ӳ�ͬ�Ƕ�����SO2��ͬ��Ļ�ѧ���ʣ�����ѧ����ʽ�����±��С�
SO2�������� | ��ѧ����ʽ | |
������� | ���������� | ��SO2+H2O |
��SO2+CaO=CaSO3 | ||
��_______ | ||
SԪ�ؼ�̬ | SΪ+4�� | ��_______ |
��SO2 +2H2S=3S+2H2O | ||
��4����ѧ�Ҿ����о������й��������ԣ�����Ҫԭ������ͼ��ʾ��
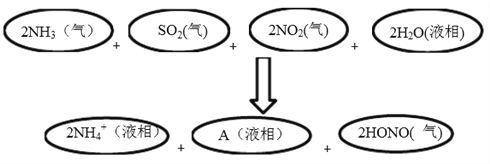
���ж�A�Ļ�ѧʽ��˵���ж����ɣ�______________________��
��5��úȼ���ŷŵ���������SO2��NOx������NaClO2��Һ��Ϊ���ռ���ͬʱ��������������������������SO2��NOx������ͨ��ʢ��NaClO2��Һ�ķ�Ӧ���У���Ӧһ��ʱ������Һ������Ũ�ȵ��й��������£��������Ӻ��Բ��ƣ���
���� | Na+ | SO42 | NO3 | H+ | Cl |
Ũ��/��mol��L1�� | 5.5��103 | 8.5��104 | y | 2.0��104 | 3.4��103 |
��SO2��NaClO2��Һ��Ӧ�����ӷ���ʽ��_________________��
�ڱ���y ��______��