��Ŀ����
����Ŀ��������������з�����ɫ��չ�����ÿɳ�����չ�������й�����
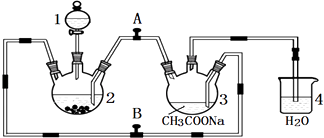
��1������һ����Ҫ����ԭ�ϣ��ϳɰ�ԭ����H2 �� ������Ȼ��Ϊԭ���Ƶã��йط�Ӧ�����仯��ͼ1��ʾ������CH4��g����H20��g����Ӧ�Ƶ�H2��g����CO��g�����Ȼ�ѧ����ʽΪ��
��2���������������Ź㷺��;�����ǻ�������Ⱦ���i����150��ʱ����0.4mol NO2����������Ϊ2L������ܱ������У�������Ӧ��2NO2��g��N2O4��g����
ÿ��һ��ʱ��ⶨ�����ڸ����ʵ����ʵ������������±���
ʱ��/S | 0 | 20 | 40 | 60 | 80 |
N��NO2��/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N��N2O4��/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
�ٵ���Ӧ��150��ﵽƽ��ʱ���÷�Ӧƽ�ⳣ��K= �� ������ֵ��
�������ͨ��N2O4 �� ����ͬ�����´ﵽƽ��ʱ��������Ũ����Ȼ��ͬ����N2O4����ʼŨ��
ӦΪ ��
��ii����������HNO3��β���к���NO��NO2 �� ��n��NO����n��NO2��=1��1������������Һ��ȥ��������ԭ���ǣ�NO2��NO��ˮ��Ӧ���������ᣬ��������������[CO�� NH2��2]��Ӧ���ɶԻ�������
Ⱦ�����ʣ�����1mol�������ո�β�����������յ�������g��
��3��������CO2��һ�������¿ɺϳ����أ��䷴ӦΪ��2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��g��ͼ2��ʾ�ϳ����а�̼��a��CO2ת���ʦصĹ�ϵ��aΪ[n��NH3����n��CO2��]��bΪˮ̼��[n��H2O����n��CO2��]����
��bӦ��������
A.1.5��1.6 B.1��1.1 C.0.6��0.7
��aӦ������4.0�������� ��
���𰸡�
��1��CH4��g��+H2O��g���TCO��g��+3H2��g����H=+171.1KJ/mol
��2��2.8��0.10mol/L��76
��3��C��a����4.0��CO2ת����Ѹ����ߵ����ֵ����a��4.0֮������c��NH3��ת��������������
���������⣺��1���ֱ����ͼ��1��2��3��֪�Ȼ�ѧ����ʽΪ��CO��g��+1/2O2��g��=CO2��g����H=��282KJ/mol ��H2��g��+1/2O2��g��=H2O��g����H=��241.8KJ/mol ��
CH4��g��+2O2��g���TCO2��g��+2H2O��g����H=��836.3KJ/mol ��
���۩��٩��ڡ�3�ɵã�CH4��g��+H2O��g��CO��g��+3H2��g����H=+171.1KJ/mol�����Դ��ǣ�CH4��g��+H2O��g��CO��g��+3H2��g����H=+171.1KJ/mol����2����i���ٸ��ݷ���ʽ�����ʼ�ļ�������ϵ����������ʽ��֪��n1=0.3mol��n2=0.07mol��n3=0.24mol��n4=0.24mol������60minʱ��Ӧ��ƽ�⣬NO2��ƽ��Ũ��Ϊ0.12mol/L��N2O4��ƽ��Ũ��Ϊ0.04mol/L���ʷ�Ӧ��ƽ�ⳣ��K= ![]() =
= ![]() =2.8�����Դ��ǣ�2.8��
=2.8�����Դ��ǣ�2.8��
�������ͨ��N2O4 �� ����ͬ�����´ﵽƽ��ʱ��������Ũ����Ȼ��ͬ������ͨ��0.4molNO2���Чƽ�⣬���ں��º��������£����յ������ϣ�����Чƽ�⣬��Ӧ����0.2molN2O4 �� ��0.1mol/L�����Դ��ǣ�0.1mol/L��
��ii������Ŀ��Ϣ��֪��NO��NO2���������ˮ��Ӧ���������ᣬ��Ӧ����ʽΪNO+NO2+H2O=2HNO2���������������ط�Ӧ����CO2��N2 �� ��Ӧ����ʽΪCO ��NH2��2+2HNO2=CO2+2N2+3H2O��
NO+NO2 ��2HNO2 ��CO��NH2��2
��30+46��g 1mol
1mol���������չ�ҵβ���е����������NO��NO2�����Ϊ1��1��������Ϊ76g�����Դ��ǣ�76����3���ٰ�̼��a[n��NH3��/n��CO2��]��ͬʱ��ˮ̼��b[n��H2O��/n��CO2��]Ϊ0.6��0.7ʱ��������̼ת����������Դ��ǣ�A��
�ڰ�̼��a[n��NH3��/n��CO2��]����4.0ʱ�������������ʵ�����������̼��ת�������Ӳ��������������ɱ�����̼��a[n��NH3��/n��CO2��]С��4.0ʱ��������̼��ת���ʽ�С��
���Դ��ǣ���̼��a[n��NH3��/n��CO2��]����4.0ʱ�������������ʵ�����������̼��ת�������Ӳ��������������ɱ�����̼��a[n��NH3��/n��CO2��]С��4.0ʱ��������̼��ת���ʽ�С��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ��㣬��Ҫ�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%���ܵó���ȷ�𰸣�