题目内容
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物。G遇KSCN溶液显红色。
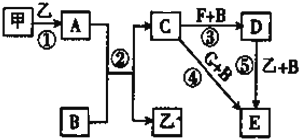
请回答下列问题:
(1)上述5个反应中,既属于氧化还原反应又属于化合反应的是_________________(填序号)。
(2)反应⑤的化学方程式为________________________________。
(3)甲与B反应的离子方程式为________________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是________________________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为________________________________。
【答案】 ①⑤ 4Fe(OH)2+O2+2H2O==4Fe(OH)3 2Na+2H2O==2Na++2OH-+H2↑ 产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀 4Fe2++4Na2O2+6H2O==4Fe(OH)3+8Na++O2↑
【解析】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,B是水,A为淡黄色固体,A是过氧化钠,所以甲和乙应该是钠和氧气。过氧化钠和水反应生成氢氧化钠和氧气,则乙是氧气,甲是钠,C是氢氧化钠。F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色,所以G是氯化铁,氢氧化钠与氯化铁反应生成氢氧化铁,E是氢氧化铁,D与氧气、水反应生成E,所以D是氢氧化亚铁,则F是氯化亚铁。
(1)根据以上分析可知上述5个反应中,既属于氧化还原反应又属于化合反应的是①和⑤。(2)反应⑤的化学方程式为4Fe(OH)2+O2+2H2O==4Fe(OH)3。(3)钠与水反应的离子方程式为2Na+2H2O==2Na++2OH-+H2↑。(4)在实验室将氢氧化钠溶液滴入氯化亚铁溶液中,观察到的现象是产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀。(5)由于过氧化钠具有强氧化性,可以把亚铁离子氧化为氢氧化铁沉淀,则根据原子守恒和电荷守恒以及电子得失守恒可知发生反应的总的离子方程式为4Fe2++4Na2O2+6H2O=4Fe(OH)3+8Na++O2↑。