题目内容
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 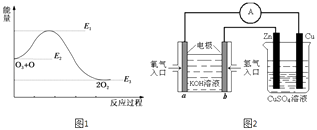
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L.
【答案】
(1)![]() KJ/mol
KJ/mol
(2)E1﹣E2
(3)(﹣2c﹣b+a)kJ?mol﹣1;低温
(4)阳;2.24
【解析】解:(1)由于反应热=反应物的键能﹣生成物的键能,设E(H﹣Cl)为Xmol,故有:E(H﹣H)+E(Cl﹣Cl)﹣2X=﹣akJ/mol,即bkJ/mol+ckJ/mol﹣2X=﹣aKJ/mol解得X= ![]() KJ/mol,故答案为:
KJ/mol,故答案为: ![]() KJ/mol;(1)(a+b+c)/2 kJmol﹣1(2分),(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1﹣E2;
KJ/mol;(1)(a+b+c)/2 kJmol﹣1(2分),(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1﹣E2;
故答案为:E1﹣E2;(3)已知①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
由盖斯定律可知,②+2×③﹣①可得C(石墨,s)+2H2(g)═CH4(g)△H=(﹣2c﹣b+a) kJmol﹣1 ,
又该反应为放热反应,△H<0,又△S<0,所以该反应在低温下△H﹣T△S<0可自发进行;
故答案为:(﹣2c﹣b+a) kJmol﹣1;低温;(4)装置图可知左边为原电池,是氢氧燃料电池,氧气一端为原电池正极,氢气一端电极为原电池负极,右边装置为电解池,与a相连的铜电极为阳极,与b电极连接的锌电极为电解池的阴极,当铜片的质量变化为12.8g时物质的量= ![]() =0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为O2+2H2O+4e﹣=4OH﹣ , 依据电子守恒得到O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,
=0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为O2+2H2O+4e﹣=4OH﹣ , 依据电子守恒得到O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,
故答案为:阳;2.24.
(1)根据反应热=反应物的键能﹣生成物的键能来分析;(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1﹣E2;(3)已知①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
由盖斯定律可知,②+2×③﹣①可得C(石墨,s)+2H2(g)═CH4(g)△H;(4)分析装置图可知左边为原电池,是氢氧燃料电池,氧气一端为原电池正极,氢气一端电极为原电池负极,右边装置为电解池,与a相连的铜电极为阳极,与b电极连接的锌电极为电解池的阴极,依据原理分析写出电极反应,结合电子守恒计算.

【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl﹣、NH4+、Mg2+、CO32﹣、Ba2+、SO42﹣ . 将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加足量BaCl2溶液,反应后进行( )、( )、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验1~3判断混合物中一定不存在的离子是;
(2)写出实验3中的空格处的实验操作;
(3)根据实验对Cl﹣是否存在的判断是(填“一定存在”、“一定不存在”或“不能确定”);
(4)溶液中K+是否存在?(填“一定存在”、“一定不存在”或“不能确定”);若“一定存在”,则K+物质的量浓度的范围(若“一定不存在”或“不能确定”不填此空).
【题目】实验室以正丁醇、溴化钠、硫酸为原料制备正溴丁烷的反应如下:
NaBr+H2SO4═HBr+NaHSO4
CH3CH2CH2CH2OH+HBr ![]() CH3CH2CH2CH2Br+H2O
CH3CH2CH2CH2Br+H2O
在圆底烧瓶中加入原料,充分振荡后加入几粒沸石,安装装置Ⅰ.加热至沸腾,反应约40min.待反应液冷却后,改装为装置Ⅱ,蒸出粗产品.部分物理性质列表如下: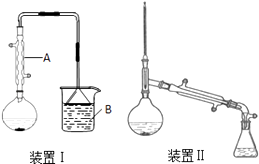
物质 | 正丁醇 | 正溴丁烷 |
沸点/℃ | 117.2 | 101.6 |
熔点/℃ | ﹣89.12 | ﹣112.4 |
密度/gcm﹣3 | 0.8098 | 1.2758 |
溶解性 | 微溶于水,溶于浓硫酸 | 不溶于水和浓硫酸 |
将所得粗产品倒入分液漏斗中,先用10mL水洗涤,除去大部分水溶性杂质,然后依次用5mL浓硫酸、10mL水、10mL饱和NaHCO3溶液、10mL水洗涤.分离出有机层,加入无水氯化钙固体,静置1h,过滤除去氯化钙,再常压蒸馏收集99~103℃馏分.
回答下列问题:
(1)仪器A的名称是 , 冷却水从A的(填“上”或“下”)口通入.
(2)在圆底烧瓶中加入的原料有:①10ml水;②7.5ml正丁醇;③10g溴化钠;④12mL浓硫酸.上述物质的加入顺序合理的是(填正确答案标号).
a.①④②③b.④①②③c.③④①②
(3)烧杯B中盛有NaOH溶液,吸收的尾气主要是(填化学式).本实验使用电热套进行加热,总共使用了次.
(4)用浓硫酸洗涤粗产品时,有机层从分液漏斗(填“上口倒出”或“下口放出”).最后一次水洗主要是洗掉
(5)制备正溴丁烷时,不直接用装置Ⅱ边反应边蒸出产物,其原因是 .
(6)本实验得到正溴丁烷6.5g,产率为(只列式,不必计算出结果).