��Ŀ����
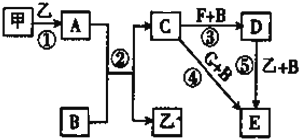
����Ŀ���ơ��صĵ⻯���������Ϳ�ѧʵ������ʮ����Ҫ��Ӧ�ã���ҵ���õ⡢NaOH����мΪԭ�Ͽ������⻯�ƣ�������������ͼ1�� 
��1��NaOH��Һ�͵ⷴӦʱ��Ҫ�ϸ�����¶ȣ�����¶ȹ��ͣ������ɵ�ĵͼ۸���ƷNaIO����NaOH��Һ�͵ⷴӦʱ������Һ��IO3����IO�������ʵ���֮��Ϊ1��1����÷�Ӧ�����ӷ���ʽΪ ��
��2�����������м��������м��Ŀ���� �� �������ù����г�ʣ����м�⣬���к��ɫ���壬�������мʱ������Ӧ�Ļ�ѧ����ʽ�� ��
��3����Һ2�г�����H+�⣬һ�����е����������������ʵ��֤ʵ�ý��������ӵĴ��� ��
��4����Һ2��һϵ��ת�����Եõ������������壨FeC2O42H2O������ȡ3.60g�����������壨��Է���������180�������ط���������ȷֽ⣬�õ�ʣ�������������¶ȱ仯��������ͼ2��ʾ������ͼ�����ݣ�������Ϣд�����̢���2�Ļ�ѧ����ʽ ��
��300��ʱʣ�����ֻ��һ�����������������ͨ������ȷ����������Ļ�ѧʽ ��
���𰸡�
��1��4I2+8OH��=IO3��+IO��+6I��+4H2O
��2����NaIO3��ȫת��ΪNaI��3H2O+2Fe+NaIO3=NaI+2Fe��OH��3��
��3��Fe2+��ȡ��Һ�����Ӹ��������Һ������Һ��ɫ��Fe2+ �� ��֮����
��4��FeC2O4?2H2O ![]() FeC2O4+2H2O��Fe2O3
FeC2O4+2H2O��Fe2O3
���������⣺��1��NaOH��Һ�͵ⷴӦʱ������Һ��IO3����IO�������ʵ���֮��Ϊ1��1������Ϊ1mol���ɵ����غ��֪������I��Ϊ ![]() =6mol����ϵ���غ㼰ԭ���غ��֪���ӷ�ӦΪ4I2+8OH��=IO3��+IO��+6I��+4H2O�����Դ��ǣ�4I2+8OH��=IO3��+IO��+6I��+4H2O����2�����������м��Ŀ���ǽ�NaIO3��ȫת��ΪNaI��������мʱ������Ӧ�Ļ�ѧ����ʽΪ3H2O+2Fe+NaIO3=NaI+2Fe��OH��3�������Դ��ǣ���NaIO3��ȫת��ΪNaI��3H2O+2Fe+NaIO3=NaI+2Fe��OH��3������3�������г�ʣ����м�⣬���к��ɫ���壬������õ���Һ2������H+�⣬������ȫ�ܽ⣬һ�����е���������Fe2+ �� ֤ʵ�ý��������ӵĴ��ڷ���Ϊȡ��Һ�����Ӹ��������Һ������Һ��ɫ��Fe2+ �� ��֮������
=6mol����ϵ���غ㼰ԭ���غ��֪���ӷ�ӦΪ4I2+8OH��=IO3��+IO��+6I��+4H2O�����Դ��ǣ�4I2+8OH��=IO3��+IO��+6I��+4H2O����2�����������м��Ŀ���ǽ�NaIO3��ȫת��ΪNaI��������мʱ������Ӧ�Ļ�ѧ����ʽΪ3H2O+2Fe+NaIO3=NaI+2Fe��OH��3�������Դ��ǣ���NaIO3��ȫת��ΪNaI��3H2O+2Fe+NaIO3=NaI+2Fe��OH��3������3�������г�ʣ����м�⣬���к��ɫ���壬������õ���Һ2������H+�⣬������ȫ�ܽ⣬һ�����е���������Fe2+ �� ֤ʵ�ý��������ӵĴ��ڷ���Ϊȡ��Һ�����Ӹ��������Һ������Һ��ɫ��Fe2+ �� ��֮������
���Դ��ǣ�Fe2+��ȡ��Һ�����Ӹ��������Һ������Һ��ɫ��Fe2+ �� ��֮��������4����3.60g�����������壬���ʵ���Ϊ0.2mol������Iʹ����������3.60��2.88g=0.72g��ǡ��Ϊ0.4molˮ������������̢����ķ�Ӧ�ǣ�����������������ʧȥ�ᾧˮ����Ӧ�Ļ�ѧ����ʽΪ��FeC2O42H2O ![]() FeC2O4+2H2O��
FeC2O4+2H2O��
���Դ��ǣ�FeC2O42H2O ![]() FeC2O4+2H2O��
FeC2O4+2H2O��
�ڲ������������е���Ԫ������Ϊ��3.6g�� ![]() ��100%=1.12g���������������е���Ԫ����ȫת�����������У�
��100%=1.12g���������������е���Ԫ����ȫת�����������У�
����������Ԫ�ص�����Ϊ��1.60g��1.12g=0.48g��
��Ԫ�غ���Ԫ�ص�������Ϊ��1.12g��0.48g=7��3��
������������Ļ�ѧʽΪFexOy ��
��56x��16y=7��3��
x��y=2��3��
����������Ļ�ѧʽΪFe2O3 ��
���Դ��ǣ�Fe2O3 ��