题目内容
【题目】常温时,Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示。下列分析不正确的是
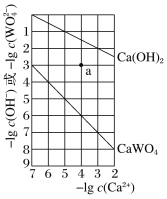
A. 常温时Ksp[Ca(OH)2]>Ksp(CaWO4)
B. a点:无Ca(OH)2沉淀,有CaWO4沉淀
C. 加热饱和Ca(OH)2溶液有白色沉淀生成
D. 常温时这两种饱和溶液中c(Ca2+)相等
【答案】D
【解析】
A.常温时,根据图像可知:根据图象分析,可计算CaWO4的溶度积常数为Ksp(CaWO4)=c(Ca2+)c(WO42-)=10-10,Ksp[Ca(OH)2]=c(Ca2+)c2(OH-)=10-7,则Ksp[Ca(OH)2]>Ksp(CaWO4),故A正确;
B.a点时,溶液中Ca2+的浓度尚未达到Ca(OH)2沉淀溶解平衡时的浓度,因此浓度积常数Qc<Ksp,所以Ca(OH)2未达到溶解平衡状态,无沉淀析出,而溶液中Ca2+的浓度大于CaWO4达到溶解平衡时的浓度,因此浓度积常数Qc>Ksp,所以有CaWO4沉淀析出,故B正确;
C.Ca(OH)2的溶解度随温度升高而降低,则加热饱和Ca(OH)2溶液有白色沉淀生成,故C正确;
D.常温时CaWO4的溶度积常数为Ksp(CaWO4)=c(Ca2+)c(WO42-)=10-10,Ksp[Ca(OH)2]=c(Ca2+)c2(OH-)=10-7,CaWO4的饱和溶液中c(Ca2+)=![]() mol/L=10-5mol/L,而Ca(OH)2的饱和溶液中c(Ca2+)=
mol/L=10-5mol/L,而Ca(OH)2的饱和溶液中c(Ca2+)=![]() mol/L,则这两种饱和溶液中c(Ca2+)不相等,故D错误;
mol/L,则这两种饱和溶液中c(Ca2+)不相等,故D错误;
故答案为D。

 优加精卷系列答案
优加精卷系列答案【题目】下列各组物质,不能按 ![]() (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | NaOH | NaHCO3 | Na2CO3 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D
【题目】A、B、C、D, E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第_______周期_______族;B元素和C元素的第一电离能比较,较大的是________,C元素和F元素的电负性比较,较小的是________。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子模型为________,B元素所形成的单质分子![]() 键与π键数目之比为________。
键与π键数目之比为________。
(3)G元素的低价阳离子的离子结构示意图是________,F元素原子的价电子的轨道表示式是________,H元素的基态原子核外电子排布式的________。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为_________________;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:_________________。


