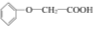
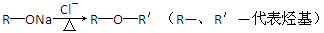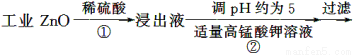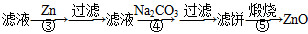题目内容
菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。
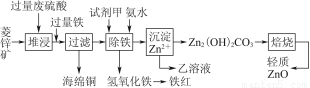
请结合下表数据,回答问题:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.3 | 9.7 |
Fe3+ | 1.5 | 3.2 |
Zn2+ | 6.2 | 8.0 |
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn b.ZnO c.Zn(OH)2 d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17 mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。
(1)C 2Fe2++H2O2+2H+=2Fe3++2H2O
(2)向过滤器中加入蒸馏水至浸没沉淀,待水自然流出,重复上述操作2~3次 用试管取少量洗涤液,滴加氯化钡溶液,若有白色沉淀则表明未洗净,反之则表明已洗净
(3)3.2≤pH<6.2 bc
(4)1.2×10-3
【解析】(1)首先明确试剂甲的作用是将Fe2+转变为Fe3+,以便除去。双氧水无疑是最佳选择。
(3)调节pH时,应使Fe3+完全沉淀而Zn2+不生成沉淀,所以最适宜的pH范围是3.2~6.2。Fe3++3H2O??Fe(OH)3+3H+,加入ZnO能发生如下反应:ZnO+2H+=Zn2++H2O,且ZnO不溶于水,随着反应的进行,c(H+)减小,Fe3+的水解平衡右移,既除去了Fe3+又不引入新的杂质,加入Zn(OH)2可以达到相同的效果,不能加入Zn,因为它能与Fe3+反应,重新引入Fe2+,不能使用CuO,否则会生成Cu2+。(4)可根据溶度积的表达式计算溶液中离子浓度。c3(OH-)=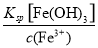 ,解得c(OH-)=1.0×10-7 mol·L-1,故c(Zn2+)=
,解得c(OH-)=1.0×10-7 mol·L-1,故c(Zn2+)=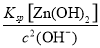 =1.2×10-3 mol·L-1。
=1.2×10-3 mol·L-1。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案