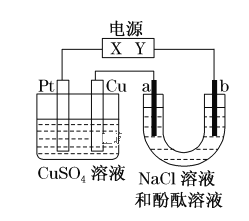
题目内容
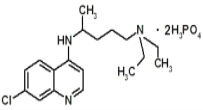
【题目】某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
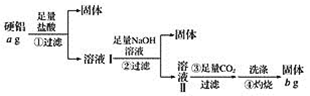
(1)溶液Ⅰ中的溶质为_________(填化学式,下同),溶液Ⅱ中的溶质为__________。
(2)上述第③步反应中,生成沉淀的离子方程式为____________。
(3)该合金中铝的含量为__________。
【答案】AlCl3、MgCl2、HCl Na[Al(OH)4]、NaCl、NaOH [Al(OH)4]-+CO2=Al(OH)3↓+HCO3— ![]()
【解析】
由测定该合金中铝的含量流程可知,①加盐酸,Cu、Si不反应,则过滤得到的固体为Cu、Si,溶液中含AlCl3、MgCl2以及过量的盐酸,②加足量的NaOH,过滤得到的沉淀为Mg(OH)2,溶液中主要含Na[Al(OH)4]、与过量盐酸反应生成的氯化钠和过量的氢氧化钠,③通足量的二氧化碳,反应生成Al(OH)3,④灼烧氢氧化铝分解得到Al2O3。
(1)根据分析可知溶液Ⅰ中的溶质为AlCl3、MgCl2、HCl;溶液Ⅱ中的溶质为Na[Al(OH)4]、NaCl、NaOH,故答案为:AlCl3、MgCl2、HCl;Na[Al(OH)4]、NaCl、NaOH;
(2)第③步通入二氧化碳与[Al(OH)4]-反应生成氢氧化铝沉淀,故答案为:[Al(OH)4]-+CO2=Al(OH)3↓+HCO3—;
(3)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为![]() ,样品质量为ag,所以铝的质量分数=
,样品质量为ag,所以铝的质量分数=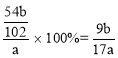 ,故答案为:
,故答案为:![]() 。
。

 同步奥数系列答案
同步奥数系列答案【题目】某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
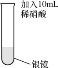
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
| 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
①补全反应中的实验现象___。
②实验Ⅰ中银镜消失发生反应的化学方程式为____。
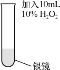
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___。
③写出该实验Ⅱ中发生反应的化学方程式:___。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
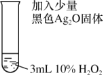
(3)探究Ag2O在H2O2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
| 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
根据实验Ⅲ的现象猜想:Ag2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____。
②实验Ⅲ中发生反应的化学方程式为___。