题目内容
10.下列离子方程式正确的是( )| A. | 氢氧化铁与盐酸反应OH-+H+═H2O | |
| B. | 次氯酸钠溶液中通入少量CO2 2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ | |
| C. | 硫酸氢钠溶液中加入氢氧化钡溶液至沉淀完全 Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 钠与水反应 Na+2H2O═Na++2OH-+H2↑ |
分析 A.氢氧化铁在离子反应中保留化学式;
B.反应生成碳酸钠和HClO;
C.加入氢氧化钡溶液至沉淀完全,以1:1反应,生成硫酸钡、水、NaOH;
D.电子、电荷不守恒.
解答 解:A.氢氧化铁与盐酸反应的离子反应为Fe(OH)3+3H+═3H2O+Fe3+,故A错误;
B.次氯酸钠溶液中通入少量CO2的离子反应为2ClO-+CO2+H2O═CO32-+2HClO,故B错误;
C.硫酸氢钠溶液中加入氢氧化钡溶液至沉淀完全的离子反应为Ba2++OH-+H++SO42-═BaSO4↓+H2O,故C正确;
D.钠与水反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
1.下列有关化学用语表示正确的是( )
| A. | 过氧化钙(CaO2)的电子式: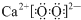 | |
| B. | ${\;}_8^{16}{O^{2-}}$离子的结构示意图: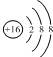 | |
| C. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{94}^{144}$Pu | |
| D. | 葡萄糖的结构简式:C6H12O6 |
5.既能与酸(H+)反应,又能与碱(OH-)反应的是( )
①MgO ②Al2O3③NaHSO4 ④NaHCO3 ⑤NH4HS.
①MgO ②Al2O3③NaHSO4 ④NaHCO3 ⑤NH4HS.
| A. | ②④⑤ | B. | ③④ | C. | ②⑤ | D. | ③④⑤ |