题目内容
8.20℃时,将0.1mol•L-1的Na2S2O3溶液和0.1mol•L-1的H2SO4溶液等体积混合,2min后溶液中明显出现浑浊.化学方程式为Na2S2O3+H2SO4═Na2SO4+S↓+H2SO3,已知温度每升高10℃,化学反应速率增大到原来的2倍,那么在50℃时,同样的反应要同样看到浑浊现象所需时间为多少?分析 已知温度每升高10℃,反应速率增大到原来的2倍,那么在50℃时,温度升高30℃,反应速率应是20℃的23倍=8倍,反应需要时间为原先的,以此解答该题.
解答 解:化学反应中,升高温度,反应速率增大,20℃时,将0.1mo l/L的Na2S2O3溶液和 0.1mol/L的硫酸等体积混合,2分钟后溶液中明显出现浑浊.即120s;
已知温度每升高10℃,反应速率增大到原来的2倍,那么在50℃时,温度升高30℃,反应速率应是20℃的23倍=8倍,反应需要时间为原先的$\frac{1}{8}$,则同样的反应出现混浊需要的时间为$\frac{120s}{8}$=15s.
答:看到浑浊所需的时间为15s.
点评 本题考查化学反应速率的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握温度升高后速率的变化倍数,为解答该题的关键,难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
16.从碳骨架形状进行分类,下列关于各有机物的说法中正确的是( )
①CH3CH2Cl、②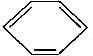 ③(CH3)2C═CH2④
③(CH3)2C═CH2④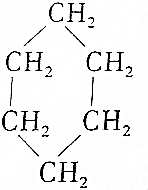 ⑤
⑤
①CH3CH2Cl、②
 ③(CH3)2C═CH2④
③(CH3)2C═CH2④ ⑤
⑤
| A. | 链状烃:①③⑤ | B. | 链状烃:①③ | C. | 环状烃:②④⑤ | D. | 芳香烃:②④ |
13. 实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:
实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:
(1)该浓硫酸中 H2SO4的物质的量浓度为18.4mol•L-1.
(2)某同学欲配制500mL物质的量浓度为0.30mol•L-1的稀硫酸,经计算需要8.15mL上述浓硫酸,则在实验操作中该同学需要量取8.2mL浓硫酸进行配制.若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒;F.胶头滴管;G.烧杯;H.500mL容量瓶.实验时应选用仪器按操作的先后顺序是E→G→C→H→A→F→(填字母).
(3)下列情况会使所配溶液浓度偏高的是AD
A.浓硫酸稀释后未冷却即转移
B.容量瓶使用前内壁沾有水珠
C.加蒸馏水时,不慎超过了刻度线
D.某同学观察液面的情况如图所示
(4)在容量瓶的使用方法中,下列操作不正确的是BC(填字母).
A.使用容量瓶前检查他是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1-2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切
D.在容量瓶中转移溶液时应用玻璃棒引流.
 实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:
实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:| 硫酸 化学式 H2SO4 相对分子质量98 密度 1.84g/cm3 质量分数98% |
(2)某同学欲配制500mL物质的量浓度为0.30mol•L-1的稀硫酸,经计算需要8.15mL上述浓硫酸,则在实验操作中该同学需要量取8.2mL浓硫酸进行配制.若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒;F.胶头滴管;G.烧杯;H.500mL容量瓶.实验时应选用仪器按操作的先后顺序是E→G→C→H→A→F→(填字母).
(3)下列情况会使所配溶液浓度偏高的是AD
A.浓硫酸稀释后未冷却即转移
B.容量瓶使用前内壁沾有水珠
C.加蒸馏水时,不慎超过了刻度线
D.某同学观察液面的情况如图所示
(4)在容量瓶的使用方法中,下列操作不正确的是BC(填字母).
A.使用容量瓶前检查他是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1-2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切
D.在容量瓶中转移溶液时应用玻璃棒引流.
14.下列物质间的转化在给定条件下不能实现的是( )
| A. | Al2O3$→_{△}^{NaOH(ap)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
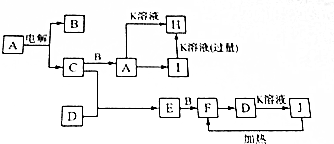
 .
.
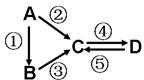 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: