题目内容
14.实验室配制250mL 0.5mol/L的Na2CO3溶液,有如下操作步骤:①将称量好的Na2CO3固体放入烧杯中,加入适量的蒸馏水溶解;②把①所得溶液小心转入250mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面与刻度线相切;④用少量蒸馏水洗涤烧杯2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;⑤计算所需Na2CO3固体的质量并用托盘天平称取;⑥塞紧容量瓶的塞子,充分摇匀.回答下列问题:(1)本实验操作步骤的正确顺序是(填序号)⑤①②④③⑥.
(2)本实验中除用到容量瓶和烧杯外,还需要用到的玻璃仪器有玻璃棒,胶头滴管.
(3)实验中用托盘天平实际称取Na2CO3固体的质量是13.3g.
(4)在实验中,若出现如下情况,对所配溶液的浓度有何影响?
未进行操作④,所配溶液的浓度会偏低(填“偏高”、“偏低”或“无影响”,下同);定容时俯视液面,所配溶液的浓度会偏高.
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度实验失败,重新配制,
向容量瓶中转移溶液时,不慎有少量溶液洒在容量瓶外面实验失败,重新配制.
分析 (1)根据实验操作的步骤;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器分析;
(3)根据n=cV求出溶质的物质的量,再根据m=nM求出溶质的质量,根据天平的精确度确定称量的质量;
(4)根据C=$\frac{n}{V}$计算不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高.
(5)根据配制过程中出现了错误,必须重新配制.
解答 解:(1)因配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,故答案为:⑤①②④③⑥;
(2)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:玻璃棒、胶头滴管;
(3)Na2CO3的物质的量n=cV=0.25L×0.5mol•L-1=0.125mol,Na2CO3的质量为0.125mol×106g/mol=13.25g,因天平的精确度为0.1g,所以托盘天平实际称取Na2CO3固体的质量为13.3g,故答案为:13.3g;
(4)因烧杯内壁沾有溶质,未用少量蒸馏水洗涤烧杯2~3次,溶质的质量减少,浓度偏小;
定容时俯视液面,溶液的液面未达到刻度线,溶液的体积偏小,浓度偏大,故答案为:偏低;偏高;
(5)根据配制过程中出现了错误,实验失败,必须重新配制.故答案为:实验失败,重新配制;实验失败,重新配制.
点评 本题考查了一定物质的量浓度溶液的配制过程、仪器以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

 阅读快车系列答案
阅读快车系列答案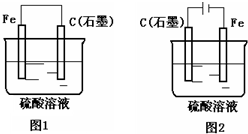
| A. | 两装置中,铁电极均要消耗 | |
| B. | 图2装置中两极均有气泡产生 | |
| C. | 图1装置铁电极上发生的电极反应为:Fe-3e-═Fe3+ | |
| D. | 随着反应的进行,图1装置中溶液的pH增大,图2装置中溶液的pH不变 |
①MgO ②Al2O3③NaHSO4 ④NaHCO3 ⑤NH4HS.
| A. | ②④⑤ | B. | ③④ | C. | ②⑤ | D. | ③④⑤ |
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Q | 与L同族 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
| A. | 1mol 任何气体的体积都约为22.4L | |
| B. | 1mol 任何物质在标准状况下所占的体积都约是22.4L | |
| C. | 标准状况下,1mol 水所占有的体积是22.4 L | |
| D. | 标准状况下,22.4L的任何气体的物质的量都约是1 mol |
 .
.