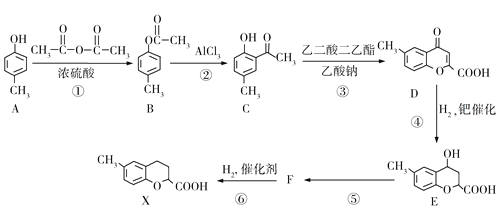
题目内容
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
【答案】ADBCE加快反应速率,使反应充分进行除去Cl2O中的Cl22Cl2+Na2CO3===Cl2O+2NaCl+CO2(或2Cl2+Na2CO3+H2O===Cl2O+2NaCl+2NaHCO3)防止反应放热后温度过高导致Cl2O分解制得的次氯酸溶液纯度较高,浓度较大1.000mol·L-1
【解析】
A装置用二氧化锰和浓盐酸制备氯气,由D装置饱和食盐水吸收氯气中的氯化氢气体,与空气形成1:3的混合气体通入B装置,防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中,在搅拌棒的作用下与含水8%的碳酸钠充分反应制备Cl2O,反应为:2Cl2+Na2CO3═Cl2O+2NaCl+CO2,通入C装置吸收除去Cl2O中的Cl2,并在E装置中用水吸收Cl2O制备次氯酸溶液,据此分析作答。
(1)A装置制备氯气,D装置吸收吸收氯气中的氯化氢气体,与空气形成1:3的混合气体通入B装置,与含水8%的碳酸钠充分反应制备Cl2O,C装置吸收除去Cl2O中的Cl2,E装置中用水吸收Cl2O制备次氯酸溶液;故答案为:A、D、B、C、E;(2)装置B中多孔球泡和搅拌棒的作用是加快反应速率,使反应充分进行;装置C装置有足量的四氯化碳溶液,其作用是除去Cl2O中的Cl2;(3)氯气和空气(不参与反应)按体积比1:3混合通入含水8%的碳酸钠中制备Cl2O,反应为:2Cl2+Na2CO3═Cl2O+2NaCl+CO2或2Cl2+Na2CO3+H2O═Cl2O+2NaCl+2NaCO3;(4)由题可知:Cl2O 42℃以上会分解生成Cl2和O2,故为防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中;(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是制得的次氯酸溶液纯度较高,浓度较大;(6)根据反应H2O+ClO-+2Fe2+=Cl-+2Fe3++2OH-、MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,则原次氯酸溶液的浓度为![]() =1.000mol·L-1。
=1.000mol·L-1。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)比较元素①、②的简单氢化物的稳定性______________________(用化学式表示);
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,(填写化学式) 元素③的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5) Na2O2的电子式为___________;CO2的电子式为_________;
(6)在⑦与⑩的单质中,氧化性较强的是_______________,用化学反应方程式证明:_____________________________。
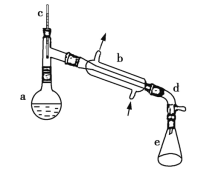
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示。
![]()
![]()
![]() +H2O
+H2O
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL 浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是___________________。
(2)加入碎瓷片的作用是___________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___________________ (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并___________________;在本实验分离过程中,产物应该从分液漏斗的___________________ (填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是___________________。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有____________ (填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器