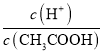题目内容
【题目】常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7B.2.0C.12.0D.12.4
【答案】B
【解析】
设溶液的体积都是1L,则氢氧化钠的物质的量为1L×0.1molL-1=0.1mol,
硫酸的物质的量为1L×0.06molL-1=0.06mol,H+的物质的量为0.06mol×2=0.12mol,
则当酸碱发生中和时H+和OH-的物质的量分别为0.12mol和0.1mol,
则硫酸过量,过量的H+的物质的量为0.12mol-0.1mol=0.02mol,
则反应后溶液中H+的物质的量浓度为c(H+)=![]() =0.01molL-1,
=0.01molL-1,
pH=-lg10-2=2.0,故选B.

 金博士一点全通系列答案
金博士一点全通系列答案【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)滴定终点的判断:溶液由_____________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(_____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为_________mL。

(4)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
第一次 | 25.00 | 0.00 | 26.15 | ①V=__________ |
第二次 | 25.00 | 0.56 | 30.30 | |
第三次 | 25.00 | 0.20 | 26.35 | |
②依据上表数据计算该NaOH溶液的物质的量浓度________ (计算结果取4位有效数)。