��Ŀ����
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ���̪��ָʾ��������д���пհף�
��1���ζ��յ���жϣ���Һ��_____________��
��2�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵�����_____��
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��3�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ��������������Һ�����Ϊ_________mL��

��4��ijѧ������3��ʵ��ֱ��¼�й����������
�ζ� ���� | ����NaOH��Һ�����/mL | 0.1000 mol/L��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ƽ���������� ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.15 | ��V=__________ |
�ڶ��� | 25.00 | 0.56 | 30.30 | |
������ | 25.00 | 0.20 | 26.35 | |
�������ϱ����ݼ����NaOH��Һ�����ʵ���Ũ��________ (������ȡ4λ��Ч��)��
���𰸡���Һǡ����dz��ɫ�����ɫ���Ұ�����ڲ��ָ���ɫ D 26.10 27.35 0.1046mol/l
��������
(1)�������̪��죬������̪����ɫ�����Եζ��յ�ʱ��Һ����ɫ�仯ӦΪ��dz��ɫ�����ɫ��
(2)����c(��)=![]() ����
����
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������ᣬ��������������
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и����Ӱ�죻
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ����ȡ����������
D����ȡ�������ʱ����ʼ���Ӷ���������ƫС���ζ�����ʱ���Ӷ���������ƫ�����ֵ
ƫС������ȡ������������ƫС��
(3)��ͼ��֪����ʼV=0.20mL������ʱV=26.30mL��������������Һ�����Ϊ26.30mL-0.20mL��
(4)��������������Һ�������֪��ƽ��ֵΪ![]() ��
��
�ڸ������ݵ���Ч�ԣ���ȥ��2�����ݣ�Ȼ�����1��3��ƽ������V(����)=26.15mL����c(��)=![]() ����������⡣
����������⡣
(1)�������̪��죬�ζ��յ�ʱ�۲���ƿ����Һ����ɫ��dz��ɫ�����ɫ���Ұ�����ڲ��ָ���ɫ����ﵽ�ζ��յ㡣��Ϊ����Һǡ����dz��ɫ�����ɫ���Ұ�����ڲ��ָ���ɫ��
(2)��c(��)=![]() ��֪��
��֪��
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������ᣬ����������������c(��)ƫ��A�������⣻
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и����Ӱ�죬B�������⣻
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ������������������c(��)ƫ��C�������⣻
D����ȡ�������ʱ����ʼ���Ӷ���������ƫС���ζ�����ʱ���Ӷ���������ƫ�����ֵƫС������ȡ������������ƫС������c(��)ƫ�ͣ�D�������⡣
����D��
(3)��ͼ��֪����ʼV=0.20mL������ʱV=26.30mL��������������Һ�����Ϊ26.30mL-0.20mL=26.10mL����Ϊ��26.10��
(4)��������������Һ�������֪��ƽ��ֵΪ![]() =27.35mL����Ϊ��27.35��
=27.35mL������27.35��
�ڸ������ݵ���Ч�ԣ���ȥ��2�����ݣ�Ȼ�����1��3��ƽ������V(����)=26.15mL����c(��)=![]() ��֪��c(��)=
��֪��c(��)=![]() =0.1046mol/l��
=0.1046mol/l��
����0.1046mol/l��

 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�����Ŀ���״����ǻ����л�����ԭ�ϣ��ֿ���Ϊȼ�������������ȼ�ϡ�
��1����ҵ�Ϻϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
ƽ�ⳣ��K | 2.041 | 0.270 | 0.012 |
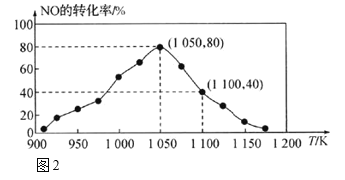
�ɱ��������жϸ÷�ӦΪ ________��Ӧ�������������������������� ij�¶��£���2 molCO��6 molH2����2 L���ܱ������г�ַ�Ӧ���ﵽƽ����c(CO)��0.2 mol/L����CO��ת����Ϊ______����ʱ���¶�Ϊ______���ӱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
��2CH3OH(l)+3O2(g)��2CO2(g)+4H2O(g) ��H1kJ/mol
��2CO(g)+O2(g)��2CO2(g) ��H2kJ/mol
��H2O(g)��H2O(l) ��H3kJ/mol
��ӦCH3OH(l)+O2(g)��CO(g)+2H2O(l) ��H�� _____________ kJ/mol������H1����H2����H3��ʾ����
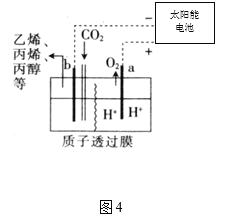
��3�����Լ״�ȼ�ϵ�أ����õ�ⷨ���������Ժ�����ˮ����Ҫ����Cr2O72��ʱ��ʵ����������ͼװ��ģ��÷���

��N�缫�ĵ缫��ӦʽΪ ___________________________________��
������ɵ�����Cr2O72ת��ΪCr3+�����ӷ�Ӧ����ʽ��
Cr2O72 + ______ Fe2+ + ______ �� ______ Cr3+ + ______ Fe3+ + ______
��4��������ˮʱ�����Cr3+��Cr(OH)3��ʽ��ȥ����c(Cr3+)��1��105 mol/Lʱ��Cr3+������ȫ����ʱ��Һ��pH��______������֪��Ksp=6.4��1031��lg2=0.3��