题目内容
13.如表为六种短周期元素的部分性质:| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
分析 主族元素中,最高正化合价与其族序数相等,最低负价=族序数-8,同一主族元素,原子半径越大其原子序数越大,根据表中数据值,X和Q属于第IVA族,X半径小于Q,则X是C、Q是Si元素;
Y是第VIA族元素,X半径大于Y,则Y是O元素;
Z和T是第VA族元素,Z半径小于T,则Z是N元素、T是P元素;
R最高价为+7价,属于第VIIA族,F元素没有最正化合价,所以R是Cl元素,再结合物质结构性质解答.
解答 解:主族元素中,最高正化合价与其族序数相等,最低负价=族序数-8,同一主族元素,原子半径越大其原子序数越大,根据表中数据值,X和Q属于第IVA族,X半径小于Q,则X是C、Q是Si元素;
Y是第VIA族元素,X半径大于Y,则Y是O元素;
Z和T是第VA族元素,Z半径小于T,则Z是N元素、T是P元素;
R最高价为+7价,属于第VIIA族,F元素没有最正化合价,所以R是Cl元素,
A.C与O可以形成阴离子CO32-,故A正确;
B.R是Cl元素,其氧化物的水化物不一定是强酸,如HClO是弱酸,故B错误;
C.N的氢化物是氨气、P的氢化物是膦,氨气分子间能形成氢键、膦分子间不能形成氢键,氢键能导致熔沸点升高,所以N的沸点比P的氢化物的沸点高,故C正确;
D.由C形成的化合物SiC和CCl4,前者是原子晶体、后者是分子晶体,所以二者晶体类型不同,故D正确;
故选B.
点评 本题考查原子结构和元素性质,侧重考查学生分析判断能力,正确判断元素是解本题关键,注意氢键对物质性质的影响,易错选项是B,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
3.在一定温度下将Cl2通入NaOH溶液中,得到ClO-、ClO3-等离子,其物质的量n(mol)随反应时间t(min)的变化如图所示.下列有关说法正确的是( )


| A. | t1时,溶液中Na+、NH4+、CO32-、S2-可以大量共存 | |
| B. | t2时,溶液中含氯微粒浓度大小:c(ClO-)>c(Cl-)>c(ClO3-) | |
| C. | t3时,离子方程式为:4Cl2+8OH-=ClO3-+ClO-+6Cl-+4H2O | |
| D. | t4时,因c(ClO-)接近于0,所以c(ClO3-)=c(Cl-) |
4.下列说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | C3H8的二氯代物共有3种 |
1. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )| A. | 最高价氧化物对应水化物的酸性最强的是W | |
| B. | Y与Z只能形成一种化合物 | |
| C. | 简单阴离子还原性:Y>W | |
| D. | Z与Q形成的化合物可能含共价键 |
8.下列说法正确的是( )
| A. | 19世纪初,化学家维勒提出了有机化学的概念 | |
| B. | 红外光谱图的研究可以确定有机物的相对分子质量 | |
| C. | 测定有机化合物中碳、氢元素质量分数的方法最早由李比希提出的 | |
| D. | 铜丝燃烧法可定性确定有机物中是否含有硫、氮、氯、溴等元素 |
18.已知M、N、R均为短周期的元素,M、N同周期,M、R的最低价离子分别为M2-和R-,N2+和R-具有相同的电子层结构,下列说法正确的是( )
| A. | 对应气态氢化物的稳定性M>R | B. | R元素的最高正价一定为+7价 | ||
| C. | 离子半径:M2->R->N2+ | D. | 还原性:M2-<R- |
2.利用图1所示实验(部分装置)收集氯气并验证氯气的性质:
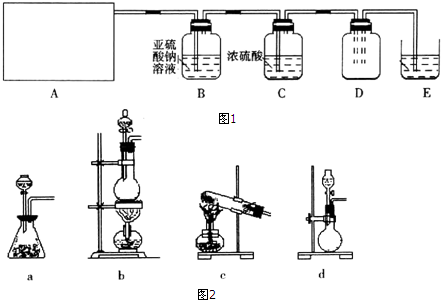
(1)A为Cl2的发生装置.若制取氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,与之对应的A装置(图2)是b(填写装置的序号).
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改).
(3)写出装置E中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,在酒精烧至红热,然后伸入盛有氯气的集气瓶中.
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.试设计实验方案,检验洗气瓶B溶液中Cl和SO42-的存在.可供选择的试剂及仪器为:
稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管.

(1)A为Cl2的发生装置.若制取氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,与之对应的A装置(图2)是b(填写装置的序号).
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改).
(3)写出装置E中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,在酒精烧至红热,然后伸入盛有氯气的集气瓶中.
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.试设计实验方案,检验洗气瓶B溶液中Cl和SO42-的存在.可供选择的试剂及仪器为:
稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量B中溶液于试管Ⅰ中,滴加过量稀盐酸和BaCl2溶液 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42- |
| 步骤2:另取适量B中溶液于试管Ⅱ中,滴加过量Ba(NO3)2溶液,振荡,静置 | 产生白色沉淀 |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加稀HNO3和AgNO3溶液. | 若产生白色沉淀,则洗气瓶白溶液中存在Cl- |
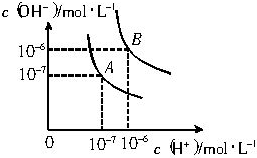 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.