题目内容
6.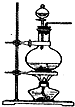 化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.
化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.(1)已知发生装置如右图所示.请写出该反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O制备实验开始时,先检查装置气密性,接下来的操作依次是ACB(填序号)
A.往烧瓶中加入MnO2粉末 B.加热
C.往烧瓶中加入浓盐酸
(2)为了制取纯净干燥的氯气,应将氯气依次通过盛有饱和食盐水,浓硫酸的试剂瓶(填试剂名称)
(3)该小组关于实验中可制得氯气体积(标准状况)的讨论正确的是C
A.若提供0.4mol HCl,MnO2不足量,则可制得氯气2.24L
B.若提供0.4mol HCl,MnO2过量,则可制得氯气2.24L
C.若有0.4mol HCl参与反应,则可制得氯气2.24L
D.若有0.4mol HCl被氧化,则可制得氯气2.24L
(4)写出工业制氯气的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
分析 (1)浓盐酸与MnO2共热反应生成氯化锰、氯气和水;
检查气密性后先向烧瓶中加入二氧化锰再用分液漏斗加入浓盐酸加热反应制取氯气;
(2)浓盐酸易挥发,从发生装置中制取的氯气含有氯化氢、水蒸汽杂质,要制取纯净干燥的氯气应分别除去氯化氢和水蒸气;
(3)依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知只有浓盐酸才能与二氧化锰反应,盐酸定量时随着反应进行盐酸浓度降低,变为稀盐酸,不再与二氧化锰反应;
(4)工业上用电解饱和食盐水方法制取氯气.
解答 解:(1)浓盐酸与MnO2共热反应生成氯化锰、氯气和水,化学方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2 H2O;
检查气密性后先向烧瓶中加入二氧化锰再用分液漏斗加入浓盐酸加热反应制取氯气,所以正确的顺序为:ACB;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2 H2O; A C B;
(2)浓盐酸易挥发,从发生装置中制取的氯气含有氯化氢、水蒸汽杂质,通过盛有饱和食盐水的洗气瓶可以除去氯化氢气体,通过盛有浓硫酸的洗气瓶可以除去水蒸气;
故答案为:饱和食盐水;浓硫酸;
(3)依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知只有浓盐酸才能与二氧化锰反应,盐酸定量时随着反应进行盐酸浓度降低,变为稀盐酸,不再与二氧化锰反应,
A.若提供0.4mol HCl,MnO2不足量,盐酸在反应过程中浓度降低,变为稀盐酸,不再反应,故得氯气小于2.24L,故A不选;
B.若提供0.4mol HCl,MnO2过量,盐酸在反应过程中浓度降低,变为稀盐酸,不再反应,故得氯气小于2.24L,故B不选;
C.若有0.4mol HCl参与反应,依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,生成氯气0.1mol,则可制得氯气2.24L,故C选;
D.依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,若有0.4mol HCl被氧化,生成0.2mol氯气,则可制得氯气4.48L,故D不选;
故选:C;
(4)工业上用电解饱和食盐水制取氯气,方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题考查了实验室、工业制备氯气的原理,明确反应原理是解题关键,注意氯气的净化,题目难度不大.

| A. | 人工牛胰岛素的合成,标志着人类在化学合成技术上迈出了重要的一步 | |
| B. | 牛胰岛素的水溶液可产生丁达尔效应 | |
| C. | 结晶牛胰岛素合成之前,应先确定每条链上氨基酸的排列顺序 | |
| D. | 结晶牛胰岛素双链之间通过肽键联接 |
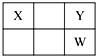 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )| A. | 最高价氧化物对应水化物的酸性最强的是W | |
| B. | Y与Z只能形成一种化合物 | |
| C. | 简单阴离子还原性:Y>W | |
| D. | Z与Q形成的化合物可能含共价键 |
| A. | 对应气态氢化物的稳定性M>R | B. | R元素的最高正价一定为+7价 | ||
| C. | 离子半径:M2->R->N2+ | D. | 还原性:M2-<R- |
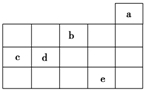 如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,
如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,下列有关叙述正确的是( )
| A. | b元素除0价外,只有一种化合价 | |
| B. | a元素形成的单质最稳定,分子式为a3 | |
| C. | c、d元素的原子半径:c<d | |
| D. | e元素在自然界中主要存在于海水中,被称为“海洋元素” |
 ②CH2=CH2③CH≡CH ④
②CH2=CH2③CH≡CH ④ ⑤
⑤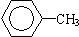 ⑥
⑥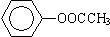 ⑦CH3CH2CH2CH2Br
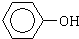
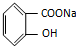
⑦CH3CH2CH2CH2Br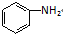 )、水杨酸(
)、水杨酸(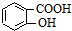 )、硝基苯与苯酚四种有机物的乙醚溶液,按如下流程利用物质的酸碱性依次分离,假设每一步分离都是完全的.(已知苯胺是一种难溶于水,具有弱碱性的有机物.)
)、硝基苯与苯酚四种有机物的乙醚溶液,按如下流程利用物质的酸碱性依次分离,假设每一步分离都是完全的.(已知苯胺是一种难溶于水,具有弱碱性的有机物.)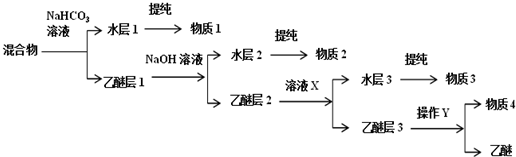
 ,物质3的分子式为C6H7N.
,物质3的分子式为C6H7N. .
.