题目内容
10.下列离子方程式书写正确的是( )| A. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 大理石放入稀硝酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 铝片插入浓烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
分析 A、HCO3-是酸式弱酸跟,在水溶液中不能完全电离;
B、大理石CaCO3是沉淀,不能拆;
C、离子方程式要满足电荷守恒和质量守恒;
D、硫酸溶液与氢氧化钡溶液反应时离子反应有两组:Ba2+与SO42-的反应,OH-与H+的反应.
解答 解:A、HCO3-是酸式弱酸跟,在水溶液中不能完全电离,即碳酸氢钠只能拆为Na+和HCO3-,故正确的离子方程式为:HCO3-+H+═H2O+CO2↑,故A错误;
B、大理石CaCO3是沉淀,不能拆,故正确的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C、铝片插入浓烧碱溶液中的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,其中能拆的有强碱NaOH和可溶性的盐NaAlO2,故正确的离子方程式为:
2Al+2OH-+2H2O═2AlO2-+3H2↑,故C正确;
D、硫酸溶液与氢氧化钡溶液反应时离子反应有两组:Ba2+与SO42-的反应,OH-与H+的反应,故离子方程式为Ba2++2OH-+2H++SO42-═2H20+BaSO4↓,故D错误;
故选C.
点评 本题考查离子方程式的书写的正误判断,题目难度不大,注意从反应是否符合反应实际的角度分析离子方程式的书写是否正确.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.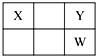 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )| A. | 最高价氧化物对应水化物的酸性最强的是W | |
| B. | Y与Z只能形成一种化合物 | |
| C. | 简单阴离子还原性:Y>W | |
| D. | Z与Q形成的化合物可能含共价键 |
18.已知M、N、R均为短周期的元素,M、N同周期,M、R的最低价离子分别为M2-和R-,N2+和R-具有相同的电子层结构,下列说法正确的是( )
| A. | 对应气态氢化物的稳定性M>R | B. | R元素的最高正价一定为+7价 | ||
| C. | 离子半径:M2->R->N2+ | D. | 还原性:M2-<R- |
15.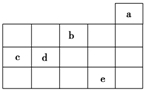 如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,
如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,
下列有关叙述正确的是( )
 如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,
如图为周期表前4周期的一部分,其中五种元素a、b、c、d、e的位置如图所示,下列有关叙述正确的是( )
| A. | b元素除0价外,只有一种化合价 | |
| B. | a元素形成的单质最稳定,分子式为a3 | |
| C. | c、d元素的原子半径:c<d | |
| D. | e元素在自然界中主要存在于海水中,被称为“海洋元素” |
2.利用图1所示实验(部分装置)收集氯气并验证氯气的性质:
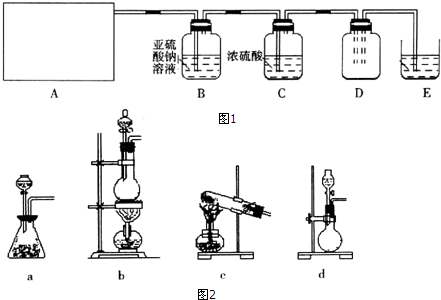
(1)A为Cl2的发生装置.若制取氯气的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,与之对应的A装置(图2)是b(填写装置的序号).
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改).
(3)写出装置E中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,在酒精烧至红热,然后伸入盛有氯气的集气瓶中.
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.试设计实验方案,检验洗气瓶B溶液中Cl和SO42-的存在.可供选择的试剂及仪器为:
稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管.

(1)A为Cl2的发生装置.若制取氯气的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,与之对应的A装置(图2)是b(填写装置的序号).
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改).
(3)写出装置E中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,在酒精烧至红热,然后伸入盛有氯气的集气瓶中.
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.试设计实验方案,检验洗气瓶B溶液中Cl和SO42-的存在.可供选择的试剂及仪器为:
稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量B中溶液于试管Ⅰ中,滴加过量稀盐酸和BaCl2溶液 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42- |
| 步骤2:另取适量B中溶液于试管Ⅱ中,滴加过量Ba(NO3)2溶液,振荡,静置 | 产生白色沉淀 |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加稀HNO3和AgNO3溶液. | 若产生白色沉淀,则洗气瓶白溶液中存在Cl- |
19.某单烯烃与氢气加成以后的产物是(CH3)2CHCH(CH3)C(CH3)3,该烯烃可能结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
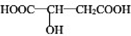 )常用于汽水、糖果的添加剂,
)常用于汽水、糖果的添加剂,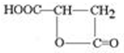 .
.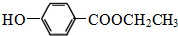
 .
.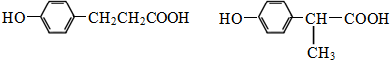 .
.