题目内容
【题目】已知铜和铁都是生活中常用的金属。
(1)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。
①写出该反应的离子方程式__________________;
②用双线桥标出该反应电子转移的方向和数目___________________;
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
③若19.2g铜与足量硝酸完全反应,被还原的硝酸为______mol,氧化剂与还原剂物质的量之比为______。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出该反应的化学方程式___________________。
②检验溶液少量Fe3+存在的方法是___________________。
【答案】3Cu+8H+ +2NO3-=3Cu2+ + 2NO↑ + 4H2O 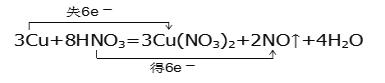 0.2 2∶3 Cu+2FeCl3=2FeCl2+CuCl2 取所得溶液少量于试管中,加入KSCN,溶液显红色,则证明含Fe3+
0.2 2∶3 Cu+2FeCl3=2FeCl2+CuCl2 取所得溶液少量于试管中,加入KSCN,溶液显红色,则证明含Fe3+
【解析】
(1)①根据离子方程式的书写方法改写;②3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中N元素由+5价变成+2价,Cu由0价变成+2价,反应中转移6个电子,据此分析解答;③反应中硝酸表现为酸性和氧化性,结合反应的化学方程式计算;
(2)①氯化铁与铜反应生成氯化亚铁和氯化铜;②实验室常用KSCN溶液检验Fe3+。
(1)①3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O的离子方程式为3Cu+8H+ +2NO3-=3Cu2+ + 2NO↑ + 4H2O;
②3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中N元素由+5价变成+2价,Cu由0价变成+2价,反应中转移6个电子,用双线桥标出该反应电子转移的方向和数目可以表示为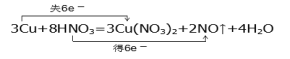 ;
;
③n(Cu)=![]() =0.3mol,由方程式可知应消耗0.8mol硝酸,反应生成0.2molNO,则有0.2mol硝酸被还原,氧化剂(HNO3)与还原剂(Cu)物质的量之比为0.2mol∶0.3mol=2∶3;
=0.3mol,由方程式可知应消耗0.8mol硝酸,反应生成0.2molNO,则有0.2mol硝酸被还原,氧化剂(HNO3)与还原剂(Cu)物质的量之比为0.2mol∶0.3mol=2∶3;
(2)①工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,氯化铁腐蚀铜反应生成氯化亚铁和氯化铜,反应的化学方程式为Cu+2FeCl3=2FeCl2+CuCl2;
②检验溶液Fe3+的方法为:取所得溶液少量于试管中,加入KSCN,溶液显红色,则证明含Fe3+。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
【题目】实验室需配制480mL 0.1 mol/L的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1 mol/L的Na2CO3溶液。
实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
____________ | ____________ |
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)____________。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1 cm~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
转移溶液后,未洗涤烧杯和玻璃棒就直接定容________;若定容时俯视刻度线__________。
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度_______________