题目内容
14.写出能实现下列反应的化学方程式各一个:(1)CO2+2OH-═CO32-+H2OCO2+2NaOH=Na2CO3+H2O
(2)Zn+2H+═Zn2++H2↑Zn+H2SO4═ZnSO4+H2↑.
分析 (1)该离子方程式表示二氧化碳与强碱反应生成可溶性的碳酸盐和水;
(2)可表示Zn与非氧化性强酸反应生成可溶性盐和氢气的离子反应.
解答 解:(1)该离子方程式表示二氧化碳与强碱反应生成可溶性的碳酸盐和水的一类反应,如:CO2+2NaOH=Na2CO3+H2O,
故答案为:CO2+2NaOH=Na2CO3+H2O;
(2)可表示Zn与非氧化性强酸反应生成可溶性盐和氢气的一类离子反应,如:Zn+H2SO4═ZnSO4+H2↑,
故答案为:Zn+H2SO4═ZnSO4+H2↑.
点评 本题考查离子反应与化学反应的书写,为高考中的经典题型,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及离子反应的意义的考查.

练习册系列答案
相关题目
4.某有机物的分子式为C5H10O,它能发生银镜反应和加成反应,若将它与H2加成,所得产物的结构简式可能是( )
| A. | (CH3)3CCH2OH | B. | CH3CH2C(CH3)2OH | C. | (CH3)3COH | D. | (CH3CH2)2CHOH |
5.一定温度下,反应2SO2+O2?2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4.缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是( )
| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 1.2mol |
2.下列实验操作可以达到实验目的是( )
| A. | 用分液漏斗分离乙醇和水的混合物 | |
| B. | 将蔗糖溶于水,加热几分钟后再加入少量新制的Cu(OH)2就可实现将蔗糖水解,并用新制的Cu(OH)2检验蔗糖的水解产物 | |
| C. | 只用溴的四氯化碳溶液就能鉴别乙烷与乙烯 | |
| D. | 用NaOH除去乙酸乙酯中的少量乙酸. | |
| E. | 向某溶液中加入NaOH溶液后再加热,若能产生使湿润红色石蕊试纸变蓝的气体,则该溶液中肯定有NH4+ | |
| F. | 现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下充分反应,有2 mol NH3生成 | |
| G. | 将乙醇迅速加热至170摄氏度制乙烯 |
19.①~⑨所代表的元素均在元素周期表前4周期,按原子半径递增的顺序进行排列,它们的主要化合价如表所示.其中⑦是过渡金属,且M层排满,未成对电子数为1,其余为主族元素.
(1)元素②在周期表中的位置是第二周期第ⅤⅡA族,②③④中第一电离能最小的元素符号是O.
(2)元素⑤的氢化物的空间构型是V型,元素⑥的氢化物中心原子的杂化方式是sp3,元素④⑥的氢化物的沸点由高到低的顺序是NH3(填分子式),理由是氨分子之间有氢键.
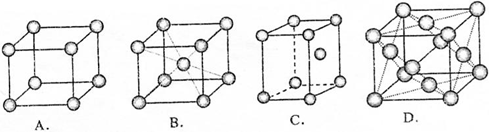
(3)元素⑨单质晶体的原子堆积方式是B.
(4)⑦的基态原子核外电子排布式为1s22s22p63s23p63d104s1,它的硫酸盐、氯化物、溴化物溶于足量的水以后呈相似的颜色,原因是在这些溶液中都含有相同的配离子是[Cu(H2O)4]2+.
(5)都由元素①③⑤⑧组成的两种化合物发生的离子反应方程式是HSO3-+H+=H2O+SO2↑.
| 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 半径(pm) | 30 | 64 | 66 | 70 | 106 | 108 | 128 | 186 | 232 |
| 主要化合价 | +1,-1 | -1 | -2 | -3,+5 | -2,+4,+6 | -3,+5 | +2 | +1 | +1 |
(2)元素⑤的氢化物的空间构型是V型,元素⑥的氢化物中心原子的杂化方式是sp3,元素④⑥的氢化物的沸点由高到低的顺序是NH3(填分子式),理由是氨分子之间有氢键.
(3)元素⑨单质晶体的原子堆积方式是B.

(4)⑦的基态原子核外电子排布式为1s22s22p63s23p63d104s1,它的硫酸盐、氯化物、溴化物溶于足量的水以后呈相似的颜色,原因是在这些溶液中都含有相同的配离子是[Cu(H2O)4]2+.
(5)都由元素①③⑤⑧组成的两种化合物发生的离子反应方程式是HSO3-+H+=H2O+SO2↑.
4.下列叙述正确的是( )
| A. | 金属元素与非金属元素能形成共价化合物 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 同一元素不可能既表现金属性,又表现非金属性 | |
| D. | 第三周期元素的最高正化合价等于它所处的主族序数 |
 .
. .
.
 甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过如图转化关系可由甲制取丁.若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题:
甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过如图转化关系可由甲制取丁.若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题: .
. HCOOCH3+H2O.
HCOOCH3+H2O.