题目内容
19.下列化学方程式中△H的值能表示可燃物的燃烧热的是( )| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol | |
| D. | CO(g)+O2(g)═CO2(g)△H=-258 kJ/mol |
分析 燃烧热表示1mol可燃物完全燃烧生成稳定氧化物所放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.
解答 解:A.燃烧热表示1mol可燃物完全燃烧生成稳定氧化物放出的热量,HCl不是氧化物,故不符合燃烧热的定义,故A错误;
B.H2O的状态为气态,不是最稳定的氧化物,所以△H不代表燃烧热,故B错误;
C.H2化学计量数为2,所以△H不代表燃烧热,故C错误;
D.CO系数为1,生成产物为二氧化碳,为稳定的氧化物,符合燃烧热的定义,所以△H代表燃烧热,故D正确;
故选:D.
点评 本题考查了燃烧热的概念,题目难度不大,理解此概念是应注意:可燃物的物质的量必须是1mol;生成的产物必须是稳定氧化物,例如碳形成二氧化碳、氢形成液态水.

练习册系列答案
相关题目
9.物质的量相同的CH4和NH3,下面各项中一定相同的是( )
| A. | 质量 | B. | 体积 | C. | 质子数 | D. | 原子数 |
10.下列各组离子一定能大量共存的是( )
| A. | 在强酸性溶液中:NH4+、Ca2+、NO3-、HCO3- | |
| B. | 强碱性溶液中:NH4+、Al3+、HCO3-、NO3- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、CO32- | |
| D. | 在无色溶液中:K+、H+、Cl-、MnO4- |
4.在下列实验中,所选用的仪器合理的是( )
| A. | 用50 mL量筒量取5.2 mL稀硫酸 | |
| B. | 用坩埚加热氯化钠溶液得到到氯化钠晶体 | |
| C. | 用托盘天平称量1.17g氯化钠晶体 | |
| D. | 用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液 |
11.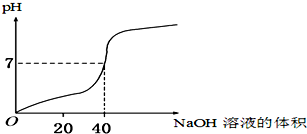 用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
 用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A. | 1.0 mol/L,20 mL | B. | 0.5 mol/L,40 mL | C. | 0.5 mol/L,80 mL | D. | 1.0 mol/L,80 mL |
 Ⅰ.实验室常用的盐酸是密度1.20g•cm-3、质量分数36.5%.
Ⅰ.实验室常用的盐酸是密度1.20g•cm-3、质量分数36.5%.