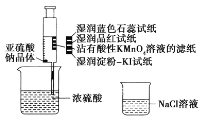
题目内容
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
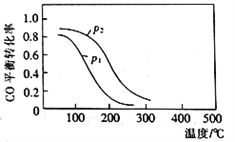
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大 b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度 d.图中压强p1<p2
③200℃时,该反应的平衡常数K =_______。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
(4)有人设计将两根 Pt 丝作电极插入 KOH 溶液中,然后向两极上分别通入乙醇和氧气而 构成燃料电池。则此燃料电池工作时,其电极反应式为:
负极:_____________
正极:_____________
【答案】-a+3b+c–d<cd6.2560%C2H5OH+16OH--12e-=2CO32-+11H2OO2+4e-+2H2O=4OH-
【解析】
(1) CH4(g)+H2O(g)=CO(g)+3H2(g)△H1,已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;②H2O (l) =H2O(g); △H=+dkJmol-1,由盖斯定律可知△H1=-a+3b+c–d kJmol-1,故答案为:-a+3b+c–d;
(2)①由图示可知在恒压条件下,随着温度的升高CO的转化率降低,说明升高温度平衡逆向移动,即正反应为放热反应,△H2<0,故答案为:<;
②a、正方向为放热反应,升高温度平衡逆向移动,平衡常数减小,故a错误;b.达平衡后再充入稀有气体,压强增大,但平衡不移动,CO的转化率不变,故b错误;c.CH4(g)+H2O(g)=CO(g)+3H2(g),达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,故c正确;d.、由图示可知,在恒温恒容的条件下,增大压强,平衡向正方向移动,CO的转化率增大,即图中压强p1<p2,故d正确;故答案为:cd;
③由图表可知,3min后反应达到平衡状态
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol·L-1) 0.4 0.8 0
变化浓度(mol·L-1) 0.2 0.4 0.2
起始浓度(mol·L-1) 0.2 0.4 0.2
200℃时,200℃时平衡常数K=c(CH3OH)/(c(CO)×c2(H2))=0.2/(0.2×0.42)=6.25;故答案为:6.25;
(3)甲烷、氧气和KOH溶液可组成燃料电池,CH4完全氧化后的产物为K2CO3,1mol甲烷完全燃烧转移电子的物质的量为[4-(-4)]mol=8mol。测得电路中转移1.2 mol电子,可知参加反应的甲烷为1.2mol/8mol ×1mol=0.15mol,标准状况下通入5.6 L甲烷的物质的量为5.6L/22.4L·mol-1=0.25mol,甲烷的利用率为0.15mol/0.25mol ×100%=60%,故答案为:60%;
(4)在燃料电池的负极发生氧化反应,通入的是乙醇,电极反应式为:C2H5OH+16OH--12e-=2CO32-+11H2O;正极发生还原反应,通入的是氧气,电极反应式为:O2+4e-+2H2O=4OH-,故答案为:C2H5OH+16OH--12e-=2CO32-+11H2O、O2+4e-+2H2O=4OH-。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆