题目内容
【题目】下列说法正确的是
A. 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度
B. 若2C(s) + O2(g) = 2CO(g) △H=—221.0kJ/mol,则碳的燃烧热为110.5 kJ/mol
C. 电解水可以获得H2和O2,该反应是放热反应
D. 已知I:反应H2(g)+Cl2(g)=2HCl(g) △H=-akJ/mol,II:![]() 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为2(a+b+c) kJ/mol
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为2(a+b+c) kJ/mol
【答案】A
【解析】A. 在中和热测定实验中,计算反应热时,需要测定反应前酸、碱溶液的温度和反应后的最高温度,总共3个温度,故A正确;B. 因C对应的稳定氧化物是二氧化碳,该反应生成的是CO,所以无法通过该反应判断C的燃烧热,故B错误;C. 电解水可以生成H2和O2,该反应为分解反应,属于吸热反应,故C错误;D. 设H-Cl键的键能为xkJ/mol,根据反应焓变△H=反应物键能总和-生成物键能总和可知,△H=b+c-2x=-akJ/mol,则断开1molH-Cl键所需吸收的能量为![]() kJ,故D错误;答案选A。
kJ,故D错误;答案选A。

练习册系列答案
相关题目
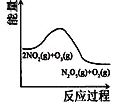
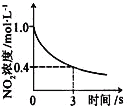
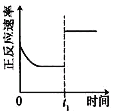
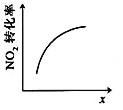
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
A | B | C | D |
|
|
|
|
升高温度,化学平衡常数增大 | 0~3秒内,反应速率 V(O3)= 0.1mol·L-1·s-1 | 加入催化剂,平衡向正反应方向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. A B. B C. C D. D