题目内容
9.下列叙述中,正确的是( )| A. | 1 mol H2的质量只有在标准状况下才约为2g | |
| B. | 在标准状况下某气体的体积是22.4L,可认为该气体的物质的量约是1mol | |
| C. | 在20℃时,1mol任何气体的体积总比22.4L大 | |
| D. | 1mol H2和O2的混合气体的质量可能为34g |
分析 A.氢气的质量与存在的状态无关;
B.根据V=nVm判断;
C.压强未知,不能确定;
D.如全部为氧气,质量为32g.
解答 解:A.氢气的质量与存在的状态无关,1mol氢气在任何情况下,质量都为2g,故A错误;
B.标准状况下气体的气体摩尔体积是22.4L/mol,则体积是22.4L,可认为该气体的物质的量约是1mol,故B正确;
C.压强未知,不能确定,故C错误;
D.如全部为氧气,质量为32g,全部为氢气,质量为2g,应介于2~32g之间,故D错误.
故选B.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关物理量的计算以及气体摩尔体积等知识,难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案
相关题目
20.下列物质均有漂白作用,其漂白原理相同的是( )
①二氧化硫
②次氯酸
③过氧化钠
④活性炭
⑤臭氧
⑥过氧化氢.
①二氧化硫
②次氯酸
③过氧化钠
④活性炭
⑤臭氧
⑥过氧化氢.
| A. | ①②⑤⑥ | B. | ①②③④ | C. | ②③⑤⑥ | D. | ①④ |
17.将一定量的铝粉与氧化铜混合加热生成铜和氧化铝,充分反应后,为了检验氧化铜是否完全反应,取反应后的固体,加入足量的稀硫酸中,充分反应后,再将铁片插入溶液中,下列现象,能说明氧化铜没有完全反应的是( )
①加入稀硫酸有气泡产生 ②加入稀硫酸后,没有气泡生成 ③加入稀硫酸后,溶液中有红色不溶物出现 ④插入溶液中铁片表面有红色物质析出.
①加入稀硫酸有气泡产生 ②加入稀硫酸后,没有气泡生成 ③加入稀硫酸后,溶液中有红色不溶物出现 ④插入溶液中铁片表面有红色物质析出.
| A. | 只有②③ | B. | 只有③④ | C. | 只有④ | D. | ①②③④ |
14.工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
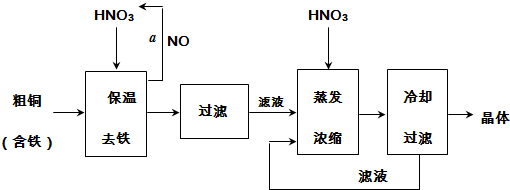
(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是4NO+3O2+2H2O=4HNO3.
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7范围.若调节溶液的pH=4,此时,溶液中c (Fe3+)=4.0×10-6mol•L-1.[已知该条件下,Fe(OH)3的KSP=4.0×10-36]
(3)不用加水的方法调节溶液pH的原因是加水会将溶液稀释,不利于将滤液蒸发浓缩.
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明)由于Cu2+发生水解:Cu2++2H2O Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.
(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是Cu2++2e-=Cu.

(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是4NO+3O2+2H2O=4HNO3.
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7范围.若调节溶液的pH=4,此时,溶液中c (Fe3+)=4.0×10-6mol•L-1.[已知该条件下,Fe(OH)3的KSP=4.0×10-36]
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明)由于Cu2+发生水解:Cu2++2H2O
 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是Cu2++2e-=Cu.
1.下列离子方程式不正确的是( )
| A. | 用过量的氨水吸收二氧化硫:2NH3•H2O+SO2═2NH4++SO${\;}_{3}^{2-}$?+H2O | |
| B. | Al(OH)3沉淀中滴加盐酸 Al(OH)3+3H+═Al3++3H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 碳酸氢钠溶液中滴加氢氧化钠:HCO3-+OH-═CO32-+H2O |
19.已知某二元酸H2A溶于水发生电离:H2A=H++HA-;HA-?H++A2-,则酸式盐MHA溶于水电离出的离子中,一定不能发生水解的是( )
| A. | M+ | B. | HA- | C. | A2- | D. | M+和HA- |
 氮及其化合物在生产、生活中有极其重要的作用.
氮及其化合物在生产、生活中有极其重要的作用.