题目内容
【题目】如图是元素周期表的一部分:
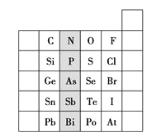
(1)阴影部分元素的外围电子排布式的通式为______。
(2)氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
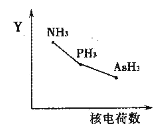
A.稳定性 B.沸点 C.R—H键能 D.分子间作用力
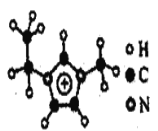
(3)如图EMIM+离子中,碳原子的杂化轨道类型为______。分子中的大π键可用符号πnm表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则EMM+离子中的大π键应表示为______。
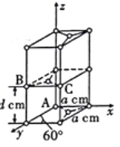
(4)晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,1/2),则C原子的坐标参数为___________。
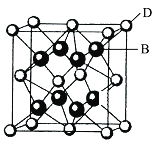
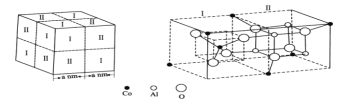
(5)钴蓝晶体结构如下图,该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,晶体中Al3+占据O2-形成的__(填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为____g·cm-3(列计算式)。
【答案】ns2np3 AC sp2、sp3 ![]()
![]() CoAl2O4 八面体空隙
CoAl2O4 八面体空隙 ![]()
【解析】
(1)阴影部分元素为氮族元素;
(2)同一主族元素的气态氢化物,非金属性越强的越稳定,其分子内的共价键的键能越大,据此分析作答;
(3)根据图示可知,环外三个烷基碳原子为sp3杂化,环内三个碳原子为sp2杂化;形成大π键的电子数=(4-3)×3+(5-3)×2-1=6;
(4)根据结构图的几何关系分析;
(5)根据晶胞的结构分析计算晶胞中原子数目,结合密度公式求解。
(1)阴影部分元素位于第VA族,其外围电子排布式的通式为:ns2np3;
(2)A.元素的非金属性越强,其氢化物越稳定,非金属性N>P>As,所以氢化物的稳定性随着原子序数增大而减弱,A项正确;
B.氢化物的熔沸点与其相对分子质量成正比,但含有氢键的熔沸点最高,氨气分子间存在氢键,因此沸点最高,所以沸点高低顺序是NH3、AsH3、PH3,B项错误;
C.原子半径越小,R-H键能越大,原子半径N<P<As,所以键能由大到小的顺序为NH3、PH3、AsH3,C项正确;
D. NH3、PH3、AsH3的相对分子质量逐渐增大,分子间作用力逐渐增大,与图示曲线不相符,D项错误;
故答案选AC;
(3)根据图示可知,环外三个碳原子都是形成4个σ键,为sp3杂化,环内三个碳原子都是形成3个σ键,1个大π键,为sp2杂化;形成大π键的电子数=(4-3)×3+(5-3)×2-1=6,则大π键可表示![]() ;答案:sp3 sp2;
;答案:sp3 sp2;![]() ;
;
(4)由B点坐标可得,a=1,d=1/2,所以C点坐标为![]() ;
;
(5)Ⅰ、Ⅱ各一个正方体为1个晶胞,该晶胞中Co原子个数=(4×1/8+2×1/4+1)×4=8个,I型和II型合起来的长方体中含有4个Al和8个O,晶胞内有4个I型和II型合起来的长方体,因而晶胞内总计有16个Al和32个O,Co、Al、O个数比为8:16:32=1:2:4,化学式为CoAl2O4;距离O2-最近的Al3+有6个,结合晶胞分析可知,6个Al3+组成八面体,因而晶体中Al3+占据O2—形成八面体空隙;每个晶胞内相当于拥有8个CoAl2O4,因而晶胞微粒质量m=![]() g,晶胞体积V=(2a×10-7)3cm3,密度等于
g,晶胞体积V=(2a×10-7)3cm3,密度等于![]() =
=![]() g/cm3=
g/cm3=![]() ,故答案为:CoAl2O4;八面体空隙;
,故答案为:CoAl2O4;八面体空隙;![]() 。
。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案