题目内容
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的电子式为__。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是__。
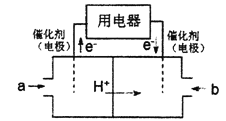
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为__,通入b气体的电极反应式__。(质子交换膜只允许H+通过)
(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
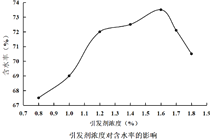
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在__左右。
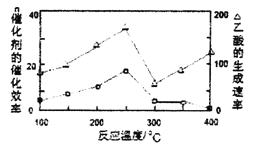
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为__。
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为__。
【答案】![]() 提供CH4分解所需的能量 负极 O2+4H++4e-=2H2O 250℃ 3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑ 1.6
提供CH4分解所需的能量 负极 O2+4H++4e-=2H2O 250℃ 3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑ 1.6
【解析】
(1)甲烷属于共价化合物,以共用电子对形成共价键;
(2)甲烷分解需要热量,燃烧可提供部分能量;
(3)由图可知,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极,通入b为氧气,得到电子,在酸性条件下生成水;
(4)①根据乙酸反应速率最大,催化活性最高选择;②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,写出离子方程式并配平;
(5)根据电子转移守恒计算;
根据以上分析解答。
(1甲烷属于共价化合物,以共用电子对形成共价键,甲烷的电子式为:![]() ;
;
答案为:![]() 。
。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是提供甲烷分解所需的能量;
答案为:提供CH4分解所需的能量。
(3)由图可知,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极,通入b为氧气,得到电子,在酸性条件下生成水,正极反应式为:O2+4H++4e-=2H2O;
答案为:负极 ;O2+4H++4e-=2H2O 。
(4)①250℃时乙酸反应速率最大,催化活性最高;
答案为:250℃。
②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,反应离子方程式为:3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑。
答案为:3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑。
(5)反应中C元素化合价由CH4里的-4价变成CO2里的+4价,N元素由NOx里的+2x变成N2里的0,根据氧化还原反应中得失电子数目相等可得关系式:8.96L[4-(-4)]=22.4L2x,解得x=1.6;
答案为:1.6。

 星级口算天天练系列答案
星级口算天天练系列答案【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜(Cu)、硒(Se)、碲(Te)外,还含有少量稀贵金属,主要物质为Cu、Cu2Se和Cu2Te。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数(%) | 0.04 | 0.76 | 0.83 | 43.47 | 17.34 | 9.23 |
(1)16S、34Se、52Te为同主族元素,其中34Se在元素周期表中的位置______。
其中铜、硒、碲的主要回收流程如下:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:Cu2Te+____H2SO4 ![]() 2CuSO4+____TeO2+____+____H2O
2CuSO4+____TeO2+____+____H2O
(3)SeO2与吸收塔中的H2O反应生成亚硒酸。焙烧产生的SO2气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为______ 。
(4)沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。
① “水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因__________。
②滤液2经过、____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
(5)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着TeO32-浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为___________________。

【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)写出下列元素的元素符号:①___,②___;
(2)在这些元素中,最活泼的金属元素是___,最不活泼的元素是___。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是___,碱性最强的是___,呈两性的氢氧化物是___。
(4)写出③和⑧的单质反应产物的电子式___。
(5)![]() C在周期表中的位置:第___周期___族,它与氧气完全燃烧的产物的电子式___。
C在周期表中的位置:第___周期___族,它与氧气完全燃烧的产物的电子式___。
(6)在③与④的单质中,化学性质较活泼的是___,判断的实验依据是___。