题目内容
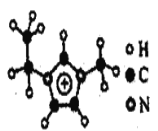
【题目】I.A~D是四种烃分子的球棍模型(如图)

(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)D和液溴反应的化学方程式是_____________。
Ⅱ. 某些有机物的转化如下图所示。 已知A的产量可以用来衡量一个国家的石油化工水平,D是食醋的有效成分。

请回答下列问题:
(4)A中官能团的名称是______________。
(5)B的结构简式为_________________。
(6)反应③的化学方程式为__________________。
【答案】C B ![]() +Br2
+Br2![]()
![]() +HBr 碳碳双键 CH3CH2OH或C2H5OH
+HBr 碳碳双键 CH3CH2OH或C2H5OH ![]()
【解析】
I.由球棍模型可知,A为甲烷,B为乙烯,C为丁烷,D为苯;结合同系物的概念和乙烯与苯的性质分析解答(1)~(3);
Ⅱ. A的产量可以用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水在一定条件下发生加成反应生成CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应CH3CHO,CH3CHO可进一步氧化生成CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应生成乙酸乙酯,据此分析解答(4)~(6)。
I.由球棍模型可知,A为甲烷,B为乙烯,C为丁烷,D为苯。
(1) 甲烷、丁烷结构相似,都是烷烃,互为同系物,故答案为:C;
(2)乙烯中含有碳碳双键,能使酸性高锰酸钾溶液褪色,故答案为:B;
(3)苯和液溴反应生成溴苯和HBr,反应的方程式为![]() +Br2
+Br2![]()
![]() +HBr,故答案为:
+HBr,故答案为:![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
Ⅱ. (4)A为乙烯(CH2=CH2),含有的官能团是碳碳双键,故答案为:碳碳双键;
(5)B的结构简式为CH3CH2OH或C2H5OH,故答案为:CH3CH2OH或C2H5OH;
(6)反应③为CH3CH2OH和CH3COOH在浓硫酸作用下反应生成乙酸乙酯,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。

【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是________。

(2)如图中表示NO2的变化的曲线是________。用NO2表示从0~2s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a. v(NO2)=2v(O2) b. 容器内压强保持不变
c. 2v逆(NO)=v正(O2) d. 容器内气体的平均摩尔质量保持不变
(4)能使该反应的反应速率增大的是________。
a. 及时分离出NO2气体 b. 适当升高温度
c. 增大O2的浓度 d. 选择高效催化剂
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜(Cu)、硒(Se)、碲(Te)外,还含有少量稀贵金属,主要物质为Cu、Cu2Se和Cu2Te。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数(%) | 0.04 | 0.76 | 0.83 | 43.47 | 17.34 | 9.23 |
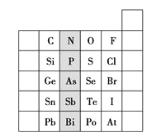
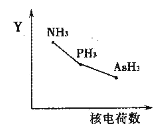
(1)16S、34Se、52Te为同主族元素,其中34Se在元素周期表中的位置______。
其中铜、硒、碲的主要回收流程如下:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:Cu2Te+____H2SO4 ![]() 2CuSO4+____TeO2+____+____H2O
2CuSO4+____TeO2+____+____H2O
(3)SeO2与吸收塔中的H2O反应生成亚硒酸。焙烧产生的SO2气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为______ 。
(4)沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。
① “水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因__________。
②滤液2经过、____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
(5)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着TeO32-浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为___________________。

【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)写出下列元素的元素符号:①___,②___;
(2)在这些元素中,最活泼的金属元素是___,最不活泼的元素是___。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是___,碱性最强的是___,呈两性的氢氧化物是___。
(4)写出③和⑧的单质反应产物的电子式___。
(5)![]() C在周期表中的位置:第___周期___族,它与氧气完全燃烧的产物的电子式___。
C在周期表中的位置:第___周期___族,它与氧气完全燃烧的产物的电子式___。
(6)在③与④的单质中,化学性质较活泼的是___,判断的实验依据是___。