题目内容
9.下列有关硫酸和硝酸的叙述正确的是( )| A. | 将浓硫酸和浓硝酸分别长期露置在空气中,浓度均会降低 | |
| B. | 在常温下,浓硫酸和浓硝酸均能与铜剧烈反应 | |
| C. | 稀硫酸和稀硝酸分别与金属反应时,S和N元素的化合价都会发生变化 | |
| D. | 因为浓硫酸和浓硝酸都能与铁反应,所以常温下二者都不能用铁制容器盛装 |
分析 A.浓硫酸具有吸水性,浓硝酸具有挥发性;
B.常温下,浓硫酸和铜不反应;
C.稀硝酸具有强氧化性,能和金属发生反应生成氮的化合物;
D.常温下,浓硫酸和浓硝酸都与铁发生钝化现象.
解答 解:A.浓硫酸具有吸水性导致溶液体积增大,浓度降低;浓硝酸具有挥发性,导致溶质减少,浓度降低,故A正确;
B.常温下,浓硫酸和铜不反应,加热条件下发生氧化还原反应生成硫酸铜、二氧化硫,故B错误;
C.稀硝酸具有强氧化性,能和金属发生反应生成氮的化合物,N元素化合价发生变化;稀硫酸和金属反应时H元素体现氧化性,所以S元素化合价不变,故C错误;
D.常温下,浓硫酸和浓硝酸都与铁发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以常温下可以用铁质容器盛放浓硫酸和浓硝酸,故D错误;
故选A.
点评 本题考查浓硫酸、浓硝酸性质,二者都具有酸性、强氧化性,注意浓硫酸和铜反应条件,注意稀硫酸的氧化性是H元素体现的,题目难度不大.

练习册系列答案
相关题目
19.下列说法不正确的是( )
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,表明乙醇已被铜氧化为乙醛 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
20.下列分散系中,分散质粒子的直径大小在1~100nm之间的是( )
| A. | CuSO4溶液 | B. | Fe(OH)3胶体 | C. | 稀硫酸 | D. | 浑浊的石灰水 |
17.下列物质中,既含极性共价键又含非极性共价键的化合物是( )
| A. | NH4Cl | B. | Cl2 | C. | H2O2 | D. | CCl4 |
4.在开发海水资源的过程中,下列物质仅通过物理变化就能获得的是( )
| A. | NaCl | B. | Cl2 | C. | Na和Mg | D. | NaOH和H2 |
14.元素x的核电荷数为a,它的阳离子xm+与元素y的阴离子yn-具有相同的电子数,则元素y的核电荷数为( )
| A. | a+m+n | B. | a-m-n | C. | a+m-n | D. | a-m+n |
18. 目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=566kJ•mol-1
③H2O(l)=H2O(g)△H=+44kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=_442.8kJ•mol-1
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除云(Co3+的还原产物是Co2+).
①写出阳极电极反应式Co2+-e-=Co3+;
②写出除云甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应.
②实验1中,以v(H2)表示的平均反应速率为0.16mol•(L•min)-1.
③900℃时,按CO(g)、H2O(g)、CO2(g)和H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)<v(逆)(填“>”“<”或“=”之一).
④实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强.
 目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=566kJ•mol-1
③H2O(l)=H2O(g)△H=+44kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=_442.8kJ•mol-1
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除云(Co3+的还原产物是Co2+).
①写出阳极电极反应式Co2+-e-=Co3+;
②写出除云甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验1中,以v(H2)表示的平均反应速率为0.16mol•(L•min)-1.
③900℃时,按CO(g)、H2O(g)、CO2(g)和H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)<v(逆)(填“>”“<”或“=”之一).
④实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强.
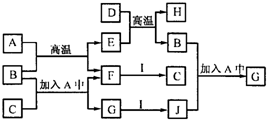 A~J为中学化学中常见的几种物质.它们有如图转化关系:
A~J为中学化学中常见的几种物质.它们有如图转化关系: