题目内容
【题目】为了探究外界条件对锌与稀硫酸反应速率的影响,设计如下方案:
编号 | 纯锌粉 | 0. 2 mol·L-1硫酸溶液 | 温度 | 硫酸铜固体 |
Ⅰ | 2. 0 g | 200. 0 mL | 25 ℃ | 0 |
Ⅱ | 2. 0 g | 200. 0 mL | 35 ℃ | 0 |
Ⅲ | 2. 0 g | 200. 0 mL | 35 ℃ | 0. 2 g |
下列叙述不正确的是
A. Ⅰ和Ⅱ实验探究温度对反应速率的影响
B. Ⅱ和Ⅲ实验探究原电池对反应速率的影响
C. 反应速率Ⅲ>Ⅱ>Ⅰ
D. 实验Ⅰ、Ⅱ、Ⅲ的变化图象如图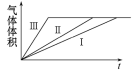
【答案】D
【解析】
A.I和Ⅱ实验中,只有温度不同,故探究温度对反应速率的影响,A正确;
B.实验Ⅲ中加入的硫酸铜与锌粉反应生成铜,从而构成原电池,加快反应速率,B正确;
C.根据A、B分析可知,反应速率Ⅲ>Ⅱ>I,C正确;
D.通过计算可知,硫酸过量,产生的气体体积由锌粉决定,Ⅲ中加入的硫酸铜消耗部分锌粉,则生成的气体减小,D错误;
综上所述,本题选D。

练习册系列答案
相关题目