题目内容
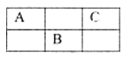
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如下图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的
| | | X | Y |
| Z | W | | |
A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X<Z<Y<W
C.与同浓度的盐酸反应,Z比W更剧烈
D.X的氧化物不能与Z单质反应
C
解析试题分析:依题意,Z原子核外的电子结构为282,则核电荷数为12,即Z为镁,读图可知,X、Y、W分别为碳、氮、铝。硝酸是氮元素最高价氧化物对应的水化物,化学式为HNO3,故A错误;主族元素原子半径与电子层数成正比例,电子层数相同时与核电荷数成反比例,则原子半径:Z>W>X>Y,即Mg>Al>C>N,故B错误;同周期主族元素的金属性随核电荷数增大而减弱,则镁的金属性比铝强,由于金属性越强,其单质与盐酸置换出氢气的反应越剧烈,则镁与盐酸反应比铝剧烈,故C正确;碳的氧化物主要是一氧化碳、二氧化碳,镁条在二氧化碳中能燃烧,发生置换反应,生成氧化镁和碳单质,故D错误。
考点:考查物质结构和元素周期律,涉及最高价氧化物对应水化物的化学式、短周期主族元素的原子半径大小、金属性强弱比较、镁与二氧化碳反应等。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法下正确的是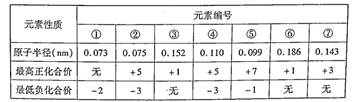
| A.⑦的简单离子不是同周期元素离子半径最小的 |
| B.气态氢化物的稳定性①>② |
| C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏 |
| D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
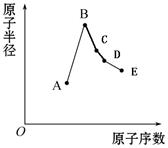
同一短周期内主族元素最高价氧化物对应水化物相同浓度稀溶液的pH与原子半径的关系如图,下列说法正确的是
| A.原子序数:W>Z>X |
| B.气态氢化物的稳定性:N>R |
| C.Y和W形成共价化合物 |
| D.X和Z两者最高价氧化物对应的水化物能相互反应 |
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则
| A.原子半径:乙>丁>丙 |
| B.非金属性:丙>丁>戊 |
| C.甲与戊形成的化合物是共价化合物 |
| D.乙、丙、丁最高价氧化物对应的水化物均是强酸 |
关于元素周期表的说法正确的是( )
| A.元素周期表有8个主族 | B.元素周期表有7个周期 |
| C.短周期是指第一、二周期 | D.第IA族的元素全部是金属元素 |
下图是短周期元素原子半径与最外层电子数的关系图,其中乙单质是半导体,下列说法正确的是( )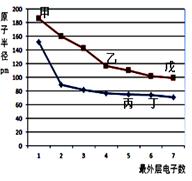
| A.丙的氢化物与丙的最高价氧化物的水化物能发生化合反应 |
| B.气态氢化物的稳定性:丙>丁>戊 |
| C.甲的离子半径比丁的简单离子半径小 |
| D.乙与丁形成的化合物含共价键,同时是两性氧化物 |
下列说法正确的是( )
| A.周期表中的主族都有非金属元素 | B.周期表中的主族都有金属元素 |
| C.周期表中的非金属元素都位于短周期 | D.周期表中的过渡元素都是金属元素 |