题目内容
【题目】我国是干电池的生产和消费大国。某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
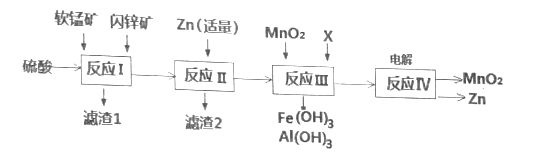
已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。
回答下列问题:
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式__________。
(2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式________________。
(3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。
(4)反应Ⅲ中X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”)。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
【答案】MnO2 + e- + H2O = MnOOH + OH— MnO2+CuS +2H2SO4 = MnSO4 + CuSO4 + S + 2H2O Cu2++Zn = Cu+ Zn2+ bd > 5
【解析】
根据流程图:软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)加入硫酸酸浸,发生反应:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O、3MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S+6H2O、MnO2+CuS+2H2SO4=MnSO4+CuSO4+S+2H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O酸浸后的过滤液中含有Mn2+、Zn2+、Fe3+、Al3+,浸取渣为S和SiO2,加入适量的Zn和铁离子反应生成亚铁离子,把铜离子转化为铜单质,过滤除去Cu,向滤液加入MnO2氧化亚铁离子为铁离子,加入Zn(OH)2或MnCO3调节溶液pH,使Fe3+和Al3+转化为沉淀,Fe3+和Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,过滤除去,得到的滤液中含硫酸锰、硫酸锌,电解,阳极生成二氧化锰,阴极生成锌,同时得到硫酸,据此分析解答。
(1)电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,锌为负极发生氧化反应,正极为二氧化锰生成MnOOH的过程,结合电解质为碱溶液和电荷守恒、原子守恒,正极反应式为MnO2+H2O+e-=MnOOH+OH-,故答案为:MnO2+H2O+e-=MnOOH+OH-;
(2)滤渣1中除SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的S单质,反应的方程式为:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S+2H2O,故答案为: M nO2+CuS+2H2SO4=MnSO4+CuSO4+S+2H2O;
(3)反应Ⅱ中加入适量金属锌可以置换出Cu进而回收Cu,反应的离子方程式为:Zn+Cu2+=Zn2++Cu,故答案为:Zn+Cu2+=Zn2++Cu;
(4)反应Ⅲ中X的作用是调节溶液pH,使Fe3+和Al3+转化为沉淀,得到的含硫酸锰、硫酸锌的溶液,abcd均可调节pH,为不引入杂质可以选择Zn(OH)2或MnCO3,故答案为:bd;
(5)已知:H2S的K2=7.0×10-15,HS-的水解平衡常数=![]() =
=![]() >K2,说明HS-的水解平衡常数大于其电离平衡常数,故溶液显碱性,pH>7;故答案为:>;
>K2,说明HS-的水解平衡常数大于其电离平衡常数,故溶液显碱性,pH>7;故答案为:>;
(6)当Qc=Ksp(MnS)时开始沉淀,调节溶液的pH=a,H2S电离常数:K2=7.0×10-15,HS-浓度为1.0×10-4molL-1时,K2=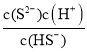 ,则7.0×10-15=
,则7.0×10-15=![]() ,则c(S2-)=7×10a-19molL-1,所以Ksp=c(Mn2+)c(S2-)=7×10a-19molL-1×0.020molL-1=1.4×10-15,解得a=5,故答案为:5。
,则c(S2-)=7×10a-19molL-1,所以Ksp=c(Mn2+)c(S2-)=7×10a-19molL-1×0.020molL-1=1.4×10-15,解得a=5,故答案为:5。