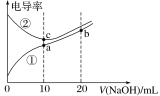
题目内容
【题目】下列各项反应对应的图像正确的是
A. 保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
B. 向少量氯化铁溶液中加入铁粉
向少量氯化铁溶液中加入铁粉
C.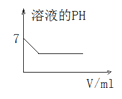 25℃时,向亚硫酸溶液中通入氯气
25℃时,向亚硫酸溶液中通入氯气
D.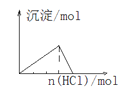 向NaAlO2溶液中通入HCl气体
向NaAlO2溶液中通入HCl气体
【答案】B
【解析】
A.BaSO4饱和溶液中,存在溶解平衡,BaSO4![]() Ba2++ SO42-,加硫酸钠,硫酸根离子浓度增大,溶解平衡逆向移动,BaSO4溶解度减小,故A错误;
Ba2++ SO42-,加硫酸钠,硫酸根离子浓度增大,溶解平衡逆向移动,BaSO4溶解度减小,故A错误;
B.向少量氯化铁溶液中加入铁粉,发生Fe+2FeCl3=3FeCl2,则Fe元素的质量增加,导致溶液的质量增加,而Cl元素的质量不变,所以Cl的质量分数减小,至反应结束不再变化,故B正确;
C.亚硫酸为弱酸,部分电离生成氢离子,溶液显酸性,pH<7,通入氯气,发生Cl2 + SO2 + 2H2O=H2SO4+2HCl,溶液的酸性增强,pH减小,直至不变,故C错误;
D.NaAlO2溶液中通入HCl气体,发生H++ AlO2-+H2O =Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,图中上升与下降段对应的横坐标长度之比应为1∶3,故D错误;
故选B。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】下表中实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
A. A B. B C. C D. D
【题目】电化学知识在物质制备领域的应用前景看好。

(1)从环境保护的角度看,制备一种新型多功能水处理剂 高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示:
①电解过程中阳极的电极反应式为______________________;
②“镁一次氯酸盐”燃料电池可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的___________(填“正"或“负")极。当有16.6 g Na2FeO4生成时消耗C1O-的物质的量为______mol;
(2)电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。则丁为_________;电解一段时间,当产生0.1 mo1气体甲时,通过离子交换膜f的离子的质量为_____________g。
(3)用0.1032 mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:
实验序号 | 消耗NaOH溶液的体积/mL | 待测稀盐酸的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
根据表格计算c(HCl)=______________。在上述滴定过程中,若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,则测定结果将__________ (填“偏大”、“偏小”或“不影响”)。