ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΡ≥–Υ»Λ–ΓΉιΡβ÷Τ±Η¬»Τχ≤Δ―ι÷ΛΤδ“ΜœΒΝ––‘÷ Θ§ Β―ιΉΑ÷Ο»γΆΦΥυ ΨΘ® Γ¬‘Φ–≥÷ΉΑ÷ΟΘ©ΓΘ“―÷ΣΘΚΝρ¥ζΝρΥαΡΤΘ®Na2S2O3Θ©»ή“Κ‘ΎΙΛ“Β…œΩ…ΉςΈΣΆ―¬»ΦΝ

ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
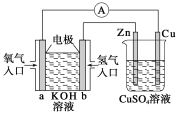
Θ®1Θ©“«ΤςaΒΡΟϊ≥Τ «______Θ§Τδ÷– Δ”–≈®―ΈΥαΘ§…’ΤΩA ÷– Δ”–ΒΡΙΧΧε ‘ΦΝ «_____Θ®ΧνΜ·―ß ΫΘ©ΓΘ
Θ®2Θ©ΉΑ÷ΟB÷– Δ”–±ΞΚΆNaCl»ή“ΚΘ§ΉΑ÷ΟBΒΡΉς”Ο «________ΓΘ
aΘ°≥ΐ»ΞC12÷–ΒΡ‘”÷ HCl bΘ°Η…‘ο
cΘ°ΧαΙ©Κσ–χΥ°’τΤχ dΘ°Ιέ≤λΉΑ÷Ο «ΖώΕ¬»ϊ
Θ®3Θ©c¥Π”–…Ϊ≤ΦΧθΆ …ΪΘ§Εχd¥Π≤ΜΆ …ΪΘ§’βΥΒΟς__________ΓΘ
Θ®4Θ© Β―ιΫα χΚσΘ§¥ρΩΣe ΒΡΜν»ϊΘ§ ΙΤδ÷–ΒΡ»ή“ΚΝς»ΥΒΫΉΕ–ΈΤΩD÷–Θ§“Γ‘»ΉΕ–ΈΤΩΘ§Ψ≤÷ΟΚσΩ…Ιέ≤λΒΫ______________________ΓΘ
Θ®5Θ©ΉΑ÷ΟE÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ____________ΓΘ
ΓΨ¥πΑΗΓΩ Ζ÷“Κ¬©ΕΖ KMnO4Θ®ΜρΓΑKClO3Γ±Β»Κœάμ ‘ΦΝ“≤Ω…Θ© acd Cl2ΈόΤ·ΑΉΉς”ΟΘ§HC1OΤπΤ·ΑΉΉς”Ο …œ≤ψ»ή“ΚΈΣΉœΚλ…Ϊ S2O32- +4C12+5H2O=2SO42- +8C1- +10H+
ΓΨΫβΈωΓΩ ‘ΧβΖ÷ΈωΘΚΘ®1Θ©ΗυΨί“«ΤςaΒΡΧΊ’ς“‘ΦΑ≥Θ”Ο“«ΤςΒΡΟϊ≥ΤΖ÷ΈωΫβ¥πΘΜΉΑ÷ΟAΈό–κΦ”»»÷Τ»Γ¬»ΤχΘ§–η―Γ‘ώ‘Ύ≥ΘΈ¬œ¬―θΜ·¬»Μ·«βΒΡ―θΜ·ΦΝΘΜΘ®2Θ©…ζ≥…ΒΡ¬»Τχ÷–Μλ”–HClΘ§ΉΑ÷ΟBΒΡΉς”Ο”–≥ΐ»Ξ¬»Τχ÷–ΒΡ¬»Μ·«βΘ§ΧαΙ©Κσ–χΥ°’τΤχΘ§≤ΔΉςΑ≤»ΪΤΩΘΜΘ®3Θ©≥± ΣΒΡ¬»ΤχΨΏ”–Τ·ΑΉ–‘Θ§Η…‘οΒΡ¬»Τχ≤ΜΨΏ±ΗΤ·ΑΉ–‘Θ§’φ’ΐΤπΤ·ΑΉΉς”ΟΒΡ «¥Έ¬»ΥαΘΜΘ®4Θ©±ΫΡήίΆ»ΓδεΥ°÷–ΒΡδεΒΞ÷ Θ§±ΫΒΡΟήΕ»±»Υ°–ΓΘΜΘ®5Θ©Na2S2O3÷–Νρœ‘+2ΦέΘ§±Μ¬»Τχ―θΜ·SO42-Θ§ΗυΨίΒΟ ßΒγΉ” ΊΚψΚΆ‘≠Ή” ΊΚψ ι–¥άκΉ”ΖΫ≥Χ ΫΓΘ
ΫβΈωΘΚΘ®1Θ©“«Τςa «¥χ”–≤ΘΝßΜν»ϊΒΡ¬©ΕΖΘ§ΈΣΖ÷“Κ¬©ΕΖΘ§Τδ÷– Δ”–≈®―ΈΥαΘ§…’ΤΩA ÷–‘Ύ≥ΘΈ¬œ¬―θΜ·¬»Μ·«β÷Τ»Γ¬»ΤχΘ§Ω…―Γ‘ώKMnO4Θ®ΜρΓΑKClO3Γ±Β»Θ©ΘΜΘ®2Θ©¬»ΤχΡ―»ή”Ύ±ΞΚΆ ≥―ΈΥ°Θ§ΒΪHClΦΪ“Ή»ή”ΎΥ°Θ§Ω…”Ο±ΞΚΆ ≥―ΈΥ°≥ΐ»Ξ¬»Τχ÷–…ΌΝΩΒΡ¬»Μ·«βΤχΧεΘ§¬»ΤχΆ®»κC÷–Θ§Ω…Ιέ≤λΒΫc¥Π≤ΦΧθΆ …ΪΘ§d¥Π≤ΜΆ …ΪΘ§ΉΑ÷ΟBΧαΙ©Κσ–χΥ°’τΤχΘ§ΖΔ…ζΕ¬»ϊ ±B÷–ΒΡ―Ι«Ω‘ω¥σΘ§B÷–≥ΛΨ±¬©ΕΖ÷–“ΚΟφ…œ…ΐΘ§–Έ≥…Υ°÷υΘ§Ω…Ιέ≤λΉΑ÷Ο «ΖώΕ¬»ϊΘ§Υυ“‘acdΖϊΚœΘΜΘ®3Θ©œρΉΑ÷Οc÷–Ά®»κ¬»ΤχΘ§d¥ΠΒΡ”–…Ϊ≤ΦΧθ≤ΜΆ …ΪΘ§“ρΈΣΗ…‘οΒΡ¬»Τχ≤ΜΨΏ±ΗΤ·ΑΉ–‘Θ§c¥ΠΒΡ”–…Ϊ≤ΦΧθΆ …ΪΘ§’βΥΒΟς¬»ΤχΨ≠Ιΐ»ή“ΚBΚσ¥χ…œΝΥΥ°Θ§≥± ΣΒΡ¬»ΤχΨΏ”–Τ·ΑΉ–‘Θ§’φ’ΐΤπΤ·ΑΉΉς”ΟΒΡ «¬»ΤχΚΆΥ°Ζ¥”Π…ζ≥…ΒΡ¥Έ¬»ΥαΘ§Υυ“‘c¥Π”–…Ϊ≤ΦΧθΆ …ΪΘ§Εχd¥Π≤ΜΆ …ΪΘ§’βΥΒΟςCl2ΈόΤ·ΑΉΉς”ΟΘ§HC1OΤπΤ·ΑΉΉς”ΟΘΜΘ®4Θ© Β―ιΫα χΚσΘ§¥ρΩΣe ΒΡΜν»ϊΘ§ ΙΤδ÷–ΒΡ»ή“ΚΝς»ΥΒΫΉΕ–ΈΤΩD÷–Θ§δεΥ°÷–Φ”»κ±Ϋ’ώΒ¥Κσ±Ϋ≤ψ≥ ≥»ΚλΖΔ…ζίΆ»ΓΘ§±ΫΒΡΟήΕ»±»Υ°–ΓΘ§…œ≤ψ»ή“ΚΈΣΉœΚλ…ΪΘΜΘ®5Θ©Na2S2O3÷–Νρœ‘+2ΦέΘ§±Μ¬»Τχ―θΜ·SO42-Θ§‘ρΉΑ÷ΟE÷–œύ”ΠΒΡάκΉ”Ζ¥”ΠΖΫ≥Χ ΫΘΚS2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ΓΘ