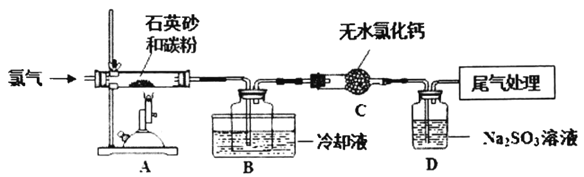
题目内容
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法中正确的是( )
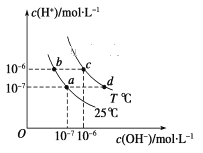
A. 若从a点到c点,可采用在水中加入酸的方法
B. b点对应的醋酸中由水电离的c(H+)=10-6 mol·L-1
C. c点对应溶液的Kw大于d点对应溶液的Kw
D. T ℃时,0.05 mol·L-1的Ba(OH)2溶液的pH=11
【答案】D
【解析】本题重点考查不同温度下水的电离平衡和水的离子积常数的计算。a点对应的c(H+)和c(OH-)相等,同理c点对应的c(H+)和c(OH-)也相等,溶液一定呈中性,从a点到c点,可以采用升温的方法,A项错误;Kw只与温度有关,同温度下不同酸碱性溶液的Kw相同,a点和b点的Kw都是10-14,c点和d点的Kw都是10-12,酸和碱溶液都会抑制水的电离,酸溶液中由水电离的c(H+)与溶液中的c(OH-)相等,即c水电离(H+)=c(OH-)=10-8mol·L-1,B、C项均错误;T℃时,Kw=10-12,0.05 mol·L-1的Ba(OH)2溶液的c(H+)=10-11mol·L-1,pH=11,D项正确。

练习册系列答案
相关题目